サルコメアの構造と部分、機能と組織学
A サルコメア それは横紋筋、すなわち骨格筋および心筋の基本的な機能単位である。骨格筋は随意運動に使用される筋肉の種類であり、心筋は心臓の一部である筋肉です。.
サルコメアが機能単位であるとは、収縮に必要なすべての成分が各サルコメアに含まれていることを意味します。実際、横紋筋は、筋肉収縮ごとに個別に短くなる何百万もの小さな筋節で構成されています.
これがサルコメアの主な目的です。サルコメアは一斉に契約することによって大きな動きを開始することができます。その独特な構造はこれらの小さい単位が筋肉の収縮を調整することを可能にします.
実際、動物の動きは非常に滑らかで複雑であるため、筋肉の収縮特性は動物の決定的な特徴です。自発運動は、筋肉が曲がるにつれて筋肉の長さの変化を必要とし、それは筋肉の短縮を可能にする分子構造を必要とする.
索引
- 1構造と部品
- 1.1筋原線維
- 1.2ミオシンとアクチン
- 1.3筋フィラメント
- 2つの機能
- 2.1ミオシンの参加
- 2.2ミオシンとアクチバの連合
- 3組織学
- 3.1バンドA
- 3.2ゾーンH
- 3.3バンドⅠ
- 3.4 Zディスク
- 3.5ラインM
- 4参考文献
構造と部品
骨格筋組織を詳細に調べると、縞模様と呼ばれる縞模様の外観が観察されます。これらの「縞」は、異なるタンパク質フィラメントに対応する、明暗の交互のバンドのパターンを表す。すなわち、これらの縞は各筋節を構成する交絡タンパク質繊維によって形成される.
筋原線維
筋繊維は筋原線維と呼ばれる何百から何千もの収縮性オルガネラで構成されています。これらの筋原線維は筋肉組織を形成するために平行に配置されている。しかしながら、筋原線維自体は本質的にポリマー、すなわちサルコメアの反復単位である。.
筋原線維は、繊維状で長い構造であり、互いに重なり合っている2種類のタンパク質フィラメントでできています。.
ミオシンとアクチン
ミオシンは球状の頭を持つ太い繊維で、アクチンは筋肉収縮の過程でミオシンと相互作用する細いフィラメントです.
所与の筋原線維は、約10,000個のサルコメアを含み、そのそれぞれの長さは約3マイクロメートルである。各サルコメアは小さいですが、いくつかの凝集したサルコメアは筋繊維の長さにまたがります.
筋フィラメント
各筋節は、上記のタンパク質の太い細い梁で構成されており、これらは一緒に筋フィラメントと呼ばれます。.
筋フィラメントの一部を拡張することで、それらを構成する分子を特定できます。細いフィラメントはアクチンでできているのに対し、太いフィラメントはミオシンでできています.
アクチンとミオシンは、相互作用すると筋肉が短くなる収縮タンパク質です。さらに、細いフィラメントは、トロポニンおよびトロポミオシンと呼ばれる調節機能を有する他のタンパク質を含み、これは収縮性タンパク質間の相互作用を調節する。.
機能
筋節の主な機能は、筋肉細胞を収縮させることです。そのためには、神経インパルスに反応して筋節を短くしなければなりません。.
太いフィラメントと細いフィラメントは縮むことはありませんが、互いの周りを滑るため、フィラメントは同じ長さを保ちながら、筋節が短くなります。このプロセスは筋肉収縮のスライディングフィラメントのモデルとして知られています.
フィラメントの滑りは筋肉の緊張を生み出します。これは疑いなくサルコメアの主な貢献です。この行為は筋肉に彼らの体力を与えます.
これとよく似ているのは、金属部品を物理的に短くすることなく、長いラダーをニーズに応じて伸縮させる方法です。.
ミオシンの関与
幸いなことに、最近の調査では、このずれがどのように機能するかについての優れたアイデアを提供しています。スライディングフィラメントの理論は、ミオシンが筋節の長さを短くするためにアクチンを引き寄せることができる方法を含むように修正されました.
この理論では、ミオシンの球状頭部はアクチンの近くのS1領域と呼ばれる領域に位置しています。この領域は、曲げることができ、したがって収縮を促進することができるヒンジを持つセグメントが豊富です.
S1の屈曲は、ミオシンがアクチンフィラメントに沿って「歩く」ことができる方法を理解するための鍵となり得る。これは、S1ミオシンフラグメントの結合サイクル、その収縮およびその最終放出によって達成される。.
ミオシンとアクチバの連合
ミオシンとアクチンが一緒になると、それらは「クロスブリッジ」と呼ばれる拡張を形成します。これらの交差した橋は、収縮を可能にするエネルギー分子であるATPの存在(または不在)で形成され、破壊される可能性があります。.
ATPがアクチンフィラメントに結合すると、それはそのミオシン結合部位を露出する位置にそれを動かす。これにより、ミオシンの球状頭部がこの部位に付着して架橋を形成することが可能になる。.
この結合はATPのリン酸基を解離させ、したがってミオシンはその機能を開始する。それから、ミオシンはより低いエネルギーの状態に入り、そこでサルコメアは短くされることができます.
次のサイクルで架橋を切断してミオシンのアクチンへの結合を再び可能にするためには、別のATP分子をミオシンに結合することが必要である。つまり、ATP分子は収縮と弛緩の両方に必要です。.
組織学
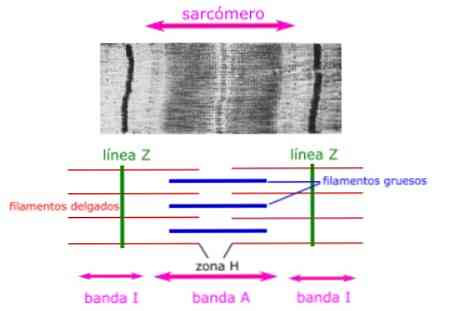
筋肉の組織学的切片は、サルコメアの解剖学的特徴を示しています。ミオシンからなる太いフィラメントは目に見え、サルコメアのAバンドとして表されます。.
アクチンからなる細いフィラメントは、α-アクチニンと呼ばれるZディスク(またはZ線)上のタンパク質に結合し、バンドIの全長とバンドAの一部に沿って存在します。.
太いフィラメントと細いフィラメントが重なり合う領域は、フィラメント間にほとんど隙間がないので、濃い外観を有する。細いフィラメントと太いフィラメントが重なるこの領域は、筋収縮にとって非常に重要です。なぜなら、それはフィラメントの動きが始まる場所だからです。.
細いフィラメントはバンドA内に完全には伸びず、厚いフィラメントのみを含むバンドAの中央領域を残す。バンドAのこの中央領域は、バンドAの他の部分よりもわずかに明るく見え、ゾーンHと呼ばれます。.
ゾーンHの中心には、アクセサリータンパク質が太いフィラメントをつなぎ合わせるMラインと呼ばれる垂直線があります。.
サルコメアの組織学の主な構成要素を以下に要約します。
バンドA
ミオシンタンパク質からなる太いフィラメントゾーン.
ゾーンH
筋肉が弛緩したときにアクチンタンパク質が重なっていないバンドAの中央帯.
バンドI
アクチンタンパク質(ミオシンなし)で構成された細いフィラメントのゾーン.
Zディスク
アクチン結合タンパク質によって形成された、隣接するサルコメア間の境界は、サルコメアに対して垂直であるか.
ラインM
アクセサリータンパク質によって形成された中央帯。それらは、筋節に垂直な、ミオシンの太いフィラメントの中心に位置しています。.
上述のように、収縮は、筋フィラメントを短くするために太いフィラメントが細いフィラメントに沿って急速に連続して滑るときに起こる。しかし、覚えておくべき重要な違いは、筋フィラメント自体は収縮しないということです。それは彼らに彼らの力を短くしたり長くしたりする力を与えるスライディングアクションです.
参考文献
- Clarke、M.(2004)。スライディングフィラメント50. 自然, 429(6988)、145.
- ヘイル、T。(2004) 運動生理学:テーマ別アプローチ (第1版)。ワイリー
- Rhoades、R.&Bell、D.(2013). 医学生理学:臨床医学の原則 (第4版)。リップピンコットウィリアムズ&ウィルキンズ.
- Spudich、J.A.(2001)。ミオシンスウィングクロスブリッジモデル. 自然レビュー分子細胞生物学, 2(5)、387〜392.
- Thibodeau、P。(2013). 解剖学および生理学 (8番目)モスビー株式会社.
- Tortora、G&Derrickson、B(2012). 解剖学および生理学の原則 (第13版)。ジョン・ワイリー&サンズ商品.


