炭酸水素カルシウムの構造、特性、リスクおよび用途
の 炭酸水素カルシウム 化学式Ca(HCO)の無機塩です。3)2. それは、石灰岩や方解石などの鉱物に含まれる炭酸カルシウムに由来します。.
炭酸水素カルシウムは炭酸カルシウムよりも水に溶けやすい。この特徴は石灰岩やカルブの構造化におけるカルストシステムの形成を可能にしました.

亀裂を通過する地下水は二酸化炭素(CO)の置換で飽和する2)これらの水は石灰岩を侵食して炭酸カルシウム(CaCO)を放出します。3それは、次の反応に従って、重炭酸カルシウムを形成する。
CaCO3+ CO2(g)+ H2O(l)=> Ca(HCO)3)2(aq)
この反応は非常に硬い水が発生する洞窟で起こります。炭酸水素カルシウムは、Caと共に固体状態ではなく水溶液中に見出される。2+, 重炭酸塩(HCO)3-)と炭酸イオン(CO)32-).
続いて、水中の二酸化炭素の飽和度が低下すると、逆の反応、すなわち重炭酸カルシウムの炭酸カルシウムへの変換が起こる。
Ca(HCO)3)2(aq)=> CO2 (g)+ H2O(l)+ CaCO3 (s)
炭酸カルシウムは水への溶解性が乏しく、これはその沈殿を固体として生じさせる。上記の反応は、鍾乳石、石筍などの洞窟での洞窟の形成において非常に重要です。.
これらの岩のような構造は洞窟の天井から落ちる水滴から形成されています(上の画像)。 CaCO3 水滴中に存在するものは結晶化して上記の構造を形成する。.
重炭酸カルシウムが固体状態では見られないという事実は、その使用を困難にしており、そしてわずかな例が見いだされている。また、その毒性影響に関する情報を見つけることは困難です。骨粗鬆症を予防するための治療としての使用の一連の副作用の報告があります.
構造
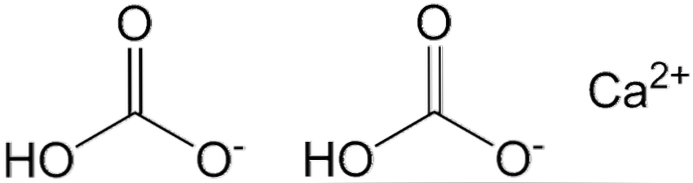
2つのHCOアニオンが上の画像に表示されています3- およびCaカチオン2+ 静電的に相互作用します。 Ca2+ 画像によると、それは中央に位置するはずです3- 彼らは彼らの負の電荷のために互いに忌避しないだろう.
HCOの負電荷3- C = Oカルボニル基とC-O結合の間の共鳴により、2つの酸素原子の間で非局在化します。-; COにいる間32-, C-OH結合は脱プロトン化されているため、共鳴によって負の電荷を帯びることがあるため、これは3つの酸素原子の間で非局在化しています。.
これらのイオンの幾何学的形状は、水素化された末端を有する炭酸塩の平らな三角形に囲まれたカルシウムの球と見なすことができる。サイズ比の点では、カルシウムはHCOイオンよりも著しく小さい3-.
水溶液
Ca(HCO)3)2 それは結晶性固体を形成することはできず、そしてそれは実際にこの塩の水溶液からなる。それらの中で、イオンはイメージのように単独ではなく、H分子に囲まれています。2○.
彼らはどのように対話しますか?各イオンは水和球体に囲まれています。水和球体は金属、極性、溶解種の構造によって異なります。.
Ca2+ 水の酸素原子と配位してアクアコンプレックス、Ca(OH)を形成します。2)n2+, ここで、nは通常6と見なされます。つまり、カルシウムの周りの「水性八面体」です。.
HCOアニオン3- どちらかの水素結合と相互作用する(または2CO-H-OH2)または負電荷非局在化(HOCO)の方向に水中の水素原子と2- H-OH、双極子 - イオン相互作用).
Ca間のこれらの相互作用2+, HCO3- そして水は非常に効率的で、重炭酸カルシウムをその溶媒に非常に溶けやすくします。 CaCOとは異なり3, Caの間の静電引力2+ そしてCO32- 非常に強く、水溶液から沈殿する.
水に加えて、CO分子があります2 ゆっくりと反応してより多くのHCOを供給します3- (pH値による).
仮説ソリッド
これまでのところ、Ca(HCO)中のイオンのサイズと電荷3)2, 固体化合物が存在しない理由を説明する。すなわち、X線結晶学によって特徴付けることができる純粋な結晶です。3)2 海底地層が成長し続ける水から存在するイオン以上のものは何もない.
はいCa2+ とHCO3- 次の化学反応を回避して、それらは水から隔離される可能性があります。
Ca(HCO)3)2(aq)→CaCO3+ CO2(g)+ H2O(l)
それからこれらは化学量論的比率2:1(2HCO)の白い結晶の固体に分類できます3/ 1Ca)。その構造についての研究はありませんが、それはNaHCOと比較することができます3 (重炭酸マグネシウムの場合、Mg(HCO)3)2, 固体としても、CaCOと一緒にも存在しません。3.
安定性:NaHCO3 vs Ca(HCO)3)2
NaHCO3 単斜晶系で結晶化し、CaCO3 三方晶系(方解石)と斜方晶系(アラゴナイト)系。 Naが置き換えられた場合+ Caのために2+, 結晶ネットワークはサイズのより大きな違いによって不安定化されるだろう。つまり、Na+ 小さいので、HCOとより安定した結晶を形成します。3- Caと比較して2+.
実際には、Ca(HCO)3)2(aq)そのイオンを結晶にまとめることができるように水を蒸発させる必要がある。しかし、これの結晶格子は室温でそれをするのに十分強くはありません。水が加熱されると、分解反応が起こります(上式)。.
Naイオンであること+ 溶液中では、これはHCOと結晶を形成します。3- 熱分解前.
その理由Ca(HCO)3)2 それは結晶化しない(理論的には)、それはその分解の前に安定な結晶を形成することができないイオン半径またはそのイオンのサイズの違いによるものである.
Ca(HCO)3)2 vs CaCO3
一方、Hが追加された場合+ CaCOの結晶構造について3, 彼らは劇的に彼らの物性を変えるでしょう。おそらく、その融点は著しく下がり、さらには結晶の形態が変わってしまう.
Ca(HCO)の合成を試す価値はあるでしょうか3)2 しっかりした?困難が予想を超える可能性があり、そして構造安定性が低い塩は、他の塩が既に使用されているいかなる用途においても有意なさらなる利益を提供しないかもしれない。.
物理的および化学的性質
化学式
Ca(HCO)3)2
分子量
162.11 g / mol
物理的な状態
固体では表示されません。それは水溶液中に見出され、それを水の蒸発により固体に変換しようと試みるが、それが炭酸カルシウムに変換されるので機能しなかった。.
水への溶解度
0℃で16.1g / 100ml。 20℃で16.6g / 100mlおよび100℃で18.4g / 100ml。これらの値は、Caイオンに対する水分子の高い親和性(HCO)を示す。3)2, 前のセクションで説明したように。その間、わずか15 mgのCaCO3 それらは1リットルの水に溶けます、それは彼らの強い静電相互作用を反映します.
Caだから(HCO)3)2 それは固体を形成することはできず、その溶解度は実験的に決定することができない。しかし、COによって作成された条件を考えると2 石灰石を囲む水に溶けば、温度Tで溶けたカルシウムの質量を計算することができます。質量、これはCa(HCO)の濃度に等しい3)2.
異なる温度で、溶解質量は0、20および100℃での値によって示されるように増加する。それで、これらの実験によると、どのくらいの量のCa(HCO)が決定されるか3)2 CaCOの近くで溶解する3 COでガス化した水性媒体中2. COが脱出したら2 ガス状のCaCO3 沈殿するが、Ca(HCO)は沈殿しない3)2.
融点と沸点
Ca(HCO)の結晶ネットワーク3)2 CaCOよりはるかに弱いです3. それが固体状態で得られ、それがフシオメータ内で融解する温度を測定するならば、それは確かに899℃よりかなり下の値を得るでしょう。同様に、沸点の決定においても同じことが予想され得る。.
燃焼点
可燃性ではありません.
リスク
この化合物は固体形態では存在しないので、それがその水溶液を操作する危険性を表すことはありそうもない。2+ HCOとして3- それらは低濃度では有害ではありません。それゆえ、そのような解決策を摂取するであろう最大のリスクは、摂取されたカルシウムの危険な投与量だけに起因するかもしれません.
たとえそれがCaCOと物理的に異なっていても、化合物が固体を形成した場合3, その毒性作用は、身体的な接触や吸入後の単純な不快感や切除を超えてはいけません。.
用途
-重炭酸カルシウム溶液は古紙、特に芸術作品や歴史的に重要な文書を洗うために長い間使われてきました。.
-重炭酸塩溶液の使用は、それらが紙の中の酸を中和するだけでなく、炭酸カルシウムのアルカリ性貯蔵量も提供するので有用である。この最後の化合物は紙の将来の損傷に対する保護を提供します.
-他の重炭酸塩と同様に、化学酵母や発泡性の錠剤や粉末の製剤に使用されています。さらに、炭酸水素カルシウムが食品添加物として使用されています(この塩の水溶液)。.
-重炭酸塩溶液は骨粗鬆症の予防に使用されてきた。しかしながら、高カルシウム血症、代謝性アルカローシスおよび腎不全などの二次的効果がある場合に観察されている。.
-重炭酸カルシウムは、心機能に対する低カリウム血症の抑うつ効果を是正するために、時折、静脈内に投与されます。.
-そして最後に、低カリウム血症状態で起こりうるアシドーシスを矯正すると同時に、筋肉収縮の媒介物質である体にカルシウムを供給します。.
参考文献
- ウィキペディア(2018)。炭酸水素カルシウム撮影元:en.wikipedia.org
- シラーデュボア。 (2017年10月3日)炭酸水素カルシウムとは取得元:livestrong.com
- 科学学習ハブ(2018)。炭酸塩化学以下から取得しました:sciencelearn.org.nz
- PubChem。 (2018)。炭酸水素カルシウム。取得元:pubchem.ncbi.nlm.nih.gov
- Amy E. Gerbracht&IreneBrückle (1997)。小規模保存ワークショップにおける炭酸水素カルシウムおよび炭酸水素マグネシウム溶液の使用調査結果取得元:cool.conservation-us.org


