臭化ナトリウム(NaBr)の化学構造、性質および用途
の 臭化ナトリウム 無機起源の塩に属する化学種です。その構造はブロモハロゲンとナトリウム金属元素が1:1の比率で構成されています。その化学式はNaBrであり、標準的な温度と圧力条件下(25℃と1気圧)で固体凝集の状態にあります.
通常、それは白色粉末として観察することができ、そしてそれはまた吸湿性挙動を示す結晶型化合物と考えられる。つまり、周囲から水分を吸収する能力があります。.

同様に、臭化ナトリウムは、同じ金属の別のイオン性化合物、塩化ナトリウムと非常に類似した物理的特性を有する。この塩化物はNaClとして表され、一般的に食塩または食卓塩として知られています。.
それは科学のさまざまな分野で多数の用途があります。例えば、それは様々な種類の薬物(とりわけ、鎮静剤、催眠剤、抗けいれん剤)の製造、ならびに有機合成において、さらには写真用途において使用されている。.
索引
- 1化学構造
- 1.1化学合成
- 2プロパティ
- 3つの用途
- 4参考文献
化学構造
前述のように、臭化ナトリウムは固相で発生し、他の多くの無機質の塩と同様に、結晶構造の立体配座を持ちます。.
臭素原子と水素原子からなるこの結晶性分子は、同じ金属のハロゲン化物塩(NaI、NaF、およびNaCl)のように、面を中心とした立方体型の配座を持っています。.
この分子配列は、次の図に示すように、各イオンが八面体図形の中心に保持されるように規則化されている多くの化合物の構造的基礎を形成します.
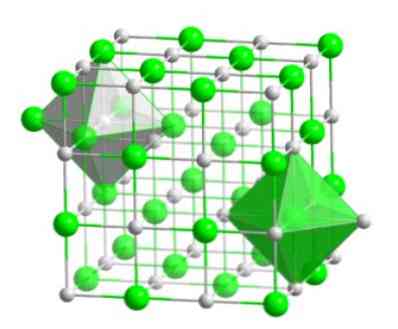
この種の結晶では、八面体図形の端にある、それぞれのイオンが周囲に6つの反対の電荷を持つイオンを持っていることがわかります。.
また、このイオン性物質の構造は、それが商業的にその2つの形態である約747℃の高融点を有することを意味する:無水種(水分子なし)および二水和種(その中に2つの水分子を含む)。構造式(NaBr・2H2その融点が異なるO)).
化学合成
臭化ナトリウムは、臭化水素(BrH、気相のハロゲン化水素)と水酸化ナトリウム(NaOH、固相の強塩基、吸湿性)の間で起こる化学反応によって引き起こされます。.
このようにして、それはNaOHの溶液に過剰の臭素を添加することによって商業的に製造される。これにより臭化物/臭素混合物が形成される。続いて、得られた生成物を乾燥するまで蒸発させ、そして炭素で処理して臭素酸イオン(BrO)の還元反応を生じさせる。3-)臭化物イオン(Br)-).
中和
同様に、この無機塩は炭酸ナトリウム(Na 2 N 4)の中和反応によっても製造することができる。2CO3)臭素酸(HBrO)3上記と同じ手順に従う。.
合成を通して、この物質は鉄と臭素および水との間の反応によって製造することができる。この反応の生成物として、臭化第一鉄 - 第二鉄種が由来する.
その後、この種が形成された(FeBrとして表される)。2/ FeBr3)を水に溶解し、一定量の炭酸ナトリウムを添加する。最後に、溶液を濾過し、そして最終的に臭化ナトリウムを得るために蒸発工程に通す。.
プロパティ
- それは普通白い粉の形で、固体凝集の状態で見られます.
- 結晶構造を持ち、面を中心とした立方体形の分子配列.
- この物質の融点は、無水の形で約747℃、二水和の形で36℃で、溶融する前に分解していることがわかります。.
- それはナトリウムイオン(Na+)と臭化物イオン(Br)-)、102.89g / molのモル質量または分子量を有する。.
- その沸点は非常に高く、1390°C(2530°Fまたは1660 Kに相当)で観測されています。.
- この種の溶解度は25℃の水中で約94.32 g / 100 mlであり、温度が上昇するにつれて上昇する.
- この物質が分解する温度まで加熱すると、有毒と考えられている臭素および酸化ナトリウムガスを放出する。.
- 無水形の臭化ナトリウムの密度は3.21 g / cmです。3, 二水和物化合物のそれは2.18g / cmである。3.
- ピリジン、アンモニア、ヒドラジンなどの他の溶媒と同様に、アルコールへの溶解度は中程度と見なされます。.
- アセトニトリル、アセトンに不溶.
用途
- 医学の分野では、それは発作を引き起こす多くの状態のための薬として、そしてウルフ - ヒルシュホルン症候群の患者におけるてんかんを予防するための療法として、ならびに鎮静および催眠治療において使用されています。.
- 獣医学ではフェノバルビタールやプリミドンなどの薬の副作用による発作性疾患のある犬に使われています.
- 石油産業の分野では、それは油井で使用されている様々な密度の特定の流体の調製プロセスで使用されています.
- 生物学的研究の分野では、その殺菌性が証明されています。つまり、さまざまな種類の細菌の発生を制御するために使用されます。.
- 有機タイプのある種の合成においては、この無機質の塩は臭素により構成される他の種の製造に使用される。例えば、Finkelsteinの反応により、より反応性の高いいくつかのハロゲン化アルキルが得られ、そのうちの1つは写真術においてかなり使用されていた。.
- 洗浄や消毒の分野では、プールやジャグジーなどで大量の水を衛生的にするために臭化ナトリウムが塩素と組み合わせて使用されます。.
参考文献
- ウィキペディア(S.F.)。臭化ナトリウム。 en.wikipedia.orgから取得しました
- PubChem。 (S.F.)。臭化ナトリウム。 pubchem.ncbi.nlm.nih.govから取得
- Johnson、A.W.(1999)。有機化学への招待books.google.co.veから取得
- サイエンスダイレクト。 (S.F.)。臭化ナトリウム。 sciencedirect.comから取得
- Riviere、J. E. and Papich、M. G.(2009)。獣医薬理学および治療学books.google.co.veから取得


