エタンの構造、性質、用途およびリスク
の エタン 式Cの単純な炭化水素2H6 無色で無臭のガスの性質を持ち、エチレンの合成に非常に価値があり多様な用途があります。さらに、それは太陽系の周りの他の惑星や星の体でも検出されている地球上のガスの一つです。それは1834年に科学者マイケル・ファラデーによって発見されました.
炭素原子と水素原子によって形成される多数の有機化合物(炭化水素として知られている)の中には、温度および環境圧力で気体状態にあるものがあり、それらは多くの産業で非常に使用されている。.
これらは通常、「天然ガス」と呼ばれる人類にとって価値の高い製品であり、とりわけメタンタイプのメタン、エタン、プロパンおよびブタンを構成しています。その鎖の中の炭素原子の量に従って分類される.
索引
- 1化学構造
- 1.1エタンの合成
- 2プロパティ
- 2.1エタンの溶解度
- 2.2エタンの結晶化
- 2.3エタンの燃焼
- 2.4大気中および天体中のエタン
- 3つの用途
- 3.1エチレン生産
- 3.2基礎化学物質のトレーニング
- 3.3冷媒
- 4エタンの危険性
- 5参考文献
化学構造
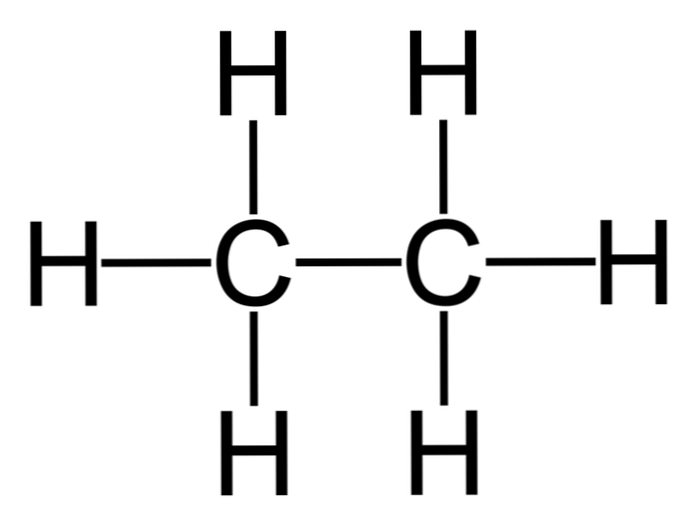
エタンは式Cの分子です。2H6, 通常は2つのメチル基の結合として見られる(-CH3)単純な炭素 - 炭素結合の炭化水素を形成する。次のように表される、メタンの後の最も単純な有機化合物でもあります。
H3C-CH3
この分子の炭素原子はsp混成を持っています3, 分子結合は自由回転を示す.
また、エタンの本質的な現象があります。これは、分子構造の回転と360度の結合の回転を生み出すのに必要な最小限のエネルギーに基づいています。.
このため、水素が互いに反対側にある場所ではより安定した立体配座が存在しますが、エタンはその回転に応じて異なる配置で発生する可能性があります(図に示すように)。.

エタンの合成
エタンは、2つの工程が起こる有機反応であるKolbeの電気分解から容易に合成することができる:2つのカルボン酸の電気化学的脱カルボキシル化(カルボキシル基の除去および二酸化炭素の放出)、ならびに生成物の組み合わせ。共有結合を形成する中間体.
同様に、酢酸の電気分解はエタンと二酸化炭素の生成につながります、そしてこの反応は最初の.
Kolbeの電気分解の概念と同様の概念である過酸化物の作用による無水酢酸の酸化もまたエタンの生成をもたらす.
同様に、極低温システムを使用してこのガスを捕獲し、それを他のガスとの混合物から分離する、液化プロセスによって天然ガスおよびメタンから効率的に分離することができる。.
ターボ膨張プロセスは、この役割に適しています。温度が-100ºC以下に下がるまで、ガス混合物をタービンに通して膨張させます。.
この時点ですでに混合物の成分を区別することができるので、液体エタンはガス状メタンおよび蒸留の使用に関与する他の種から分離されるであろう。.
プロパティ
エタンは標準的な圧力と温度(1気圧と25℃)で無臭の無色の気体として自然に発生する。沸点は-88.5℃、融点は-182.8℃です。さらに、それは強酸または強塩基への曝露による影響を受けません.
エタノール溶解度
エタンの分子は対称的な配置をしており、分散力と呼ばれる弱い引き付け力を持っています。.
エタンを水に溶解しようとすると、気体と液体との間に形成される引力が非常に弱いので、エタンを水分子と結合させることは非常に困難である。.
このため、エタンの溶解度はかなり低く、システム圧力が上昇するとわずかに増加します。.
エタンの結晶化
エタンは固化する可能性があり、その結果、立方晶の結晶構造を有する不安定なエタン結晶が形成される。.
-183.2℃を超えて温度が下がると、この構造は単斜晶系になり、分子の安定性が増します。.
エタン燃焼
この炭化水素は、燃料としては広く使用されていませんが、二酸化炭素、水、熱を発生させるための燃焼プロセスで使用できます。これは次のように表されます。
2C2H6 + 7O2 →4CO2 + 6時間2O + 3120 kJ
この分子を過剰の酸素なしで燃焼させる可能性もあり、これは「不完全燃焼」として知られ、そして適用される酸素の量に応じて、望まれない反応において非晶質炭素および一酸化炭素の形成をもたらす。 :
2C2H6 + 3O2 →4C + 6H2O +ヒート
2C2H6 + 4O2 →2C + 2CO + 6H2O +ヒート
2C2H6 + 5O2 →4CO + 6H2O +ヒート
この分野では、燃焼は一連のフリーラジカル反応を通して起こり、それらは何百もの異なる反応で番号付けされています。例えば、ホルムアルデヒド、アセトアルデヒド、メタン、メタノールおよびエタノールのような化合物は不完全燃焼反応で形成され得る。.
これは反応が起こる条件および含まれるフリーラジカル反応に依存するであろう。エチレンは高温(600〜900℃)でも生成する可能性があります。これは業界で非常に望ましい製品です。.
大気中のエタンと天体
エタンは微量で地球の大気中に存在し、そして彼が産業活動を実践し始めて以来、人間はなんとかこの濃度を倍増させたと疑われています.
科学者たちは、シェールガス製造技術が改良されて以来、エタンの世界的な排出量はほぼ半分に減少したが、大気中のエタンの現在の存在の多くは化石燃料の燃焼によるものであると考える(a天然ガス源).
この種はまた、大気中のメタンに対する太陽光線の影響によって自然に生成され、それが再結合してエタン分子を形成します。.
エタンは土星の月の一つであるタイタンの表面に液体の状態で存在しています。これはVid Flumina川でより多く発生し、それはその海の一つに向かって400キロメートル以上にわたって流れます。この化合物は彗星や冥王星の表面でも証明されています.
用途
エチレン製造
エタンの使用は主に、水蒸気分解として知られるプロセスによる、世界の生産で最も広く使われている有機製品であるエチレンの生産に基づいています。.
このプロセスは蒸気で希釈されたエタンの供給をオーブンに通過させ、酸素なしで素早く加熱することからなります.
反応は非常に高い温度(850〜900℃)で起こりますが、反応が効果的であるためには滞留時間(オーブン内でエタンが費やす時間)は短くなければなりません。より高い温度では、より多くのエチレンが生成されます.
基礎化学物質のトレーニング
エタンも塩基性化学物質の形成における主成分として研究されてきた。酸化的塩素化は、より安価でより複雑なものに代わる、塩化ビニル(PVCの成分)を得るために提案された方法の1つです。.
クーラント
最後に、エタンは一般的な極低温システムで冷媒として使用され、分析のために実験室で少量のサンプルを凍結する能力も示します。.
それは、繊細なサンプルを冷却するのにより長い時間がかかり、そしてまた有害な氷晶の形成を引き起こすことがある水の代わりになるのに非常に良いです。.
エタンリスク
-エタンは、特に空気と結合すると発火する可能性があります。空気中の3.0〜12.5体積%のエタンの割合では、爆発性混合物が形成されることがある。.
-それはそれが見出されている空気中の酸素を制限することができ、そしてこの理由のためにそれは存在して露出されている人々と動物に対する窒息の危険因子を提示.
-凍結した液体の形のエタンは、直接触れると激しく火傷を負う可能性があります。また、触った物体の極低温媒体として機能し、瞬間的に凍らせます。.
-液体エタンの蒸気は空気より重く、地面に集中しています。これは、連鎖燃焼反応を起こす可能性のある発火の危険性を提示する可能性があります.
-エタンの摂取は、吐き気、嘔吐、および内出血を引き起こす可能性があります。吸入は、窒息に加えて、頭痛、混乱および気分変動を引き起こします。高曝露量では心停止による死亡が考えられる.
-それは、メタンと二酸化炭素とともに、人類の汚染によって引き起こされる地球温暖化と気候変動の一因となる温室効果ガスです。幸いなことに、それはメタンより豊富で耐久性が低く、そしてこれより少ない放射線を吸収します.
参考文献
- ブリタニカ、E。(s.f.)。エタンbritannica.comから取得
- Nes、G.V.(s.f.)。エタン、エチレンおよびアセチレンの単結晶構造と電子密度分布rug.nlから回復しました
- サイト、G.(s.f.)。エタン:発生源と吸収源sites.google.comから取得しました
- ソフトスクール(S.F.)。エタン式。 softschools.comから回復しました
- ウィキペディア(S.F.)。エタンen.wikipedia.orgから取得しました


