水素化カルシウム(CaH 2)の特性、反応性および用途
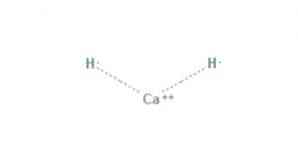
の 水素化カルシウム それはアルカリ土類水素化物になる式CaH 2の化合物です。この化合物は、図1に示すように、カルシウムと2つの水素化物イオンの間に2つのイオン結合を持っています。.
それは水素化食塩水であり、それはその構造が塩に似ていることを意味します。図2に示すように、その結晶構造は塩化鉛(コットナイト鉱物)のそれと同じです。.

全てのアルカリ金属およびアルカリ土類金属は水素化物塩を形成する。化学では、水素化物は、水素アニオン、H-、またはより一般的には、1つ以上の水素中心が求核性、還元性または塩基性の特性を有する化合物である。.
水素化物と見なされる化合物では、水素原子はより陽性の元素または基に結合しています.
カルシウムと水素を摂氏300度から400度の間の温度で反応させることによって製造することができます。水素化カルシウムを調製するための別の方法は、塩化カルシウムを水素およびナトリウム金属と共に加熱することである。反応は次のように起こります。
CaCl 2 + H 2 + 2Na→CaH 2 + 2NaCl
この反応では、カルシウム(Ca)と水素(H)が水素化カルシウムの分子を生成し、ナトリウム原子と塩素が塩化ナトリウム(NaCl)の分子を生成します。.
水素化カルシウムは、酸化カルシウム(CaO)をマグネシウム(Mg)で還元することによっても製造することができる。反応は水素の存在下で行われる。この反応は酸化マグネシウム(MgO)も生成する。下記はこの化学反応の式です:
CaO + Mg + H 2→CaH 2 + MgO
索引
- 1水素化カルシウムの理化学的性質
- 2反応性と危険性
- 3取扱い及び保管
- 4用途と用途
- 4.1乾燥剤
- 4.2水素製造
- 4.3還元剤
- 5水素化カルシウムの使用における不利な点
- 6参考文献
水素化カルシウムの物理的および化学的性質
水素化カルシウムは、純粋な場合、白い斜方晶構造を持つ結晶のセットです。一般に、この形で見つけることは稀であるため、通常は灰色がかった色合いになります。特徴的な匂いがしません。その様子を図3に示す(Royal Society of Chemistry、2015).

それは、42,094g / molの分子量を有し、816℃の融点および1.70g / mlの密度を有する。それが水に溶けると激しく反応して水素を生成する。それはまたアルコールと反応する(国立バイオテクノロジー情報センター、S.F.)。.
反応性と危険性
水素化カルシウムは安定した化学物質ですが、水や湿気に対して非常に反応性があります。水と接触すると、自然発火する可能性がある可燃性の水素ガスを放出します。.
それは爆発性化合物と見なされます。テトラヒドロフランとの反応で加熱すると、爆発する可能性があります。塩素酸塩、次亜塩素酸塩、臭素酸塩、過塩素酸カリウムと混合すると、熱、摩擦に敏感になり、爆発性になる(Calcium Hydride 7789-78-8、2016).
フッ化銀を水素化カルシウムで粉砕すると、塊は白熱光になる。水素化物を塩素、臭素またはヨウ素で強く加熱すると、白熱光が発生します。.
水素化物と種々の臭素酸塩、例えば臭素酸バリウムまたは塩素酸塩、例えば塩素酸バリウムおよび過塩素酸カリウム、例えば過塩素酸カリウムとの混合物は粉砕すると爆発する。摩擦を受けると、CaH 2はフッ化銀と白熱する.
この化合物は不活性雰囲気下で取り扱わなければならない。適切に取り扱わないと、検査員、ライフガードおよび化学廃棄物処理担当者の健康と安全に重大な脅威をもたらす可能性があります(UC検査安全センター、2013)。.
皮膚や目に入った場合は、非常に危険です。刺激があります。皮膚に接触すると非常に危険です。.
飲み込んだり吸入したりすると危険です。組織の損傷量は接触の長さによって異なります。目に触れると、角膜の損傷や失明を招く恐れがあります。.
皮膚に触れると炎症や水疱を引き起こすことがあります。粉塵を吸入すると、消化管や気道を刺激します。燃焼、くしゃみ、咳などの症状があります。.
重度の過剰暴露は、肺の損傷、窒息、意識喪失、そして死さえも引き起こす可能性があります。眼の炎症は発赤、刺激およびかゆみを特徴としています。皮膚の炎症は、かゆみ、はがれ、発赤、または時折水疱を特徴とする.
目を低レベルに繰り返しさらすと、目に刺激を与える可能性があります。繰り返し皮膚に触れると、局所的な皮膚の破壊や皮膚炎を引き起こす可能性があります。.
粉塵を繰り返し吸入すると、さまざまな程度の呼吸器への刺激や肺の損傷を引き起こすことがあります。粉じんの反復吸入または長期吸入は慢性的な呼吸器への刺激の原因となることがある(製品安全データシート水素化カルシウムMSDS、2005年).
目に入った場合は、すぐに多量の水で少なくとも15分間洗い流し、時々上下のまぶたを持ち上げます。.
皮膚に付着した場合は、直ちに汚染された衣服や靴を脱がせながら少なくとも15分間多量の水で洗い流してください.
摂取した場合、嘔吐は誘発されるべきではありません。毒物管理センターが呼ばれるべきです。展示会場を離れてすぐに屋外に移動することをお勧めします。.
吸入の場合、呼吸が困難な場合は酸素を供給する必要があります。被害者が物質を摂取または吸入した場合、口対口呼吸は行わないでください。.
人工呼吸は、一方向弁または他の適切な呼吸医療機器を備えたポケットマスクを用いて誘発されるべきである。すべての場合において、直ちに医師の診察を受けなければならない.
取り扱いと保管
化合物は、熱を避けて乾いた容器に保管してください。発火源から遠ざけてください。ほこりを吸い込まないでください。この製品に水を加えてはいけません
換気が不十分な場合は、フィルターマスクなどの適切な呼吸用保護具を着用する。ばく露の場合は、できるだけ医師の診察を受けてラベルを見せるべきです。皮膚や目との接触を避ける.
可燃性物質は、一般に、別のセキュリティキャビネットまたは保管室に保管する必要があります。容器を密閉しておく.
涼しく換気のよい場所に保管してください。電気火花を避けるための材料を含むすべての機器は接地する必要があります。容器は乾いた涼しい場所に保管してください.
それは不燃性の材料です。ただし、消防士はこの化学物質の周囲で消火する間に適切な器具を着用しなければならない.
水素化カルシウムの周りの火を消すために水を使うことは決してお勧めできません。乾燥砂、ならびにこの目的のための塩化ナトリウムおよび炭酸ナトリウムなどの化合物を使用することができる。.
水素化カルシウム廃棄物を除去するためには、撹拌しながら窒素雰囲気下で水素化物1g当たり25mlのメタノールを添加することによってそれを分解しなければならない。.
反応が終了したら、同量の水を水性カルシウムメトキシド化合物に添加し、多量の水と共に排水路に排出する(National Research Council、1995)。.
用途とアプリケーション
乾燥剤
水素化カリウムは比較的温和な乾燥剤です。この理由のために、乾燥剤としてのこの化合物の使用は、ナトリウム - カリウムおよびナトリウム金属合金のようなより反応性の高い剤と比較してより安全である。次のようにして水と反応します。
CaH 2 + 2 H 2 O→Ca(OH)2 + 2 H 2
この反応の加水分解生成物、水素(ガス)およびCa(OH)2(水性混合物)は、濾過、蒸留またはデカンテーションプロセスの後に化学溶媒から分離することができる。.
この化合物は、アミンやピリジンなどの多くの塩基性溶媒に効果的な乾燥剤です。時々それはより反応性の乾燥剤を使用する前に溶媒を予備乾燥するために使用されます.
水素製造
1940年代には、この化合物は "Hydrolith"の商品名で水素の供給源として利用可能でした。.
水素源として古くから使われてきました。それはまだ様々な実験、先進的な燃料電池および電池用途のために実験室で純粋な水素を生産するのに使われている(American Elements、S.F.)。.
化合物は気球を膨らませるための安全で便利な手段として何十年もの間広く使用されています.
同様に、実験用に少量の高純度水素を製造するために実験室で通常使用されています。ディーゼル燃料の含水量は、CaH 2処理後に発生した水素によって計算されます。.
還元剤
600〜1000℃の間で加熱すると、酸化ジルコニウム、ニオブ、ウラン、クロム、チタン、バナジウムおよびタンタルを還元してこれらの金属の粉末を製造することができるので、水素化カルシウムを冶金学において使用することができる。ほこり.
次の反応は、水素化カルシウムが還元剤として作用する方法を示しています。
TiO + 2CaH 2→CaO + H 2 + Ti
水素化カルシウムの使用における欠点
この化合物はしばしば乾燥剤として好ましい選択です。ただし、いくつかの欠点もあります。
-この化合物は、激しく反応しない溶媒には溶解しないため、乾燥速度が遅くなります。.
-この粉末化合物は多くの溶媒と相溶性がありません。クロロカーボンとの反応は爆発さえ引き起こす可能性があります。.
-溶存酸素を除去することはできないため、脱酸素溶媒には使用できません。.
-水素化カルシウムと水酸化カルシウムを区別するのは、外観が似ているため非常に困難です。.
参考文献
- アメリカの要素(S.F.)。水素化カルシウム。 americanelements.comから取得されました:americanelements.com.
- 水素化カルシウム7789−78−8。 (2016) chemicalbook.comから取得しました:chemicalbook.com.
- 水素化カルシウム。 (S.F.)。化学学習者から取得したもの:chemistrylearner.com.
- 化学物質等安全データシート水素化カルシウムMSDS。 (2005年10月10日) sciencelab.comから取得しました:sciencelab.com.
- 国立バイオテクノロジー情報センター(S.F.)。 PubChem化合物データベース。 CID = 105052 pubchem.ncbi.nlm.nih.govから取得したもの:pubchem.ncbi.nlm.nih.gov.
- 全国研究審議会。 (1995)。実験室における慎重な取扱い化学物質の取扱いと処分ワシントン州:NationalAcademy Press.
- 化学の王立協会。 (2015)水素化カルシウムID94784。chemspider.comから取得:chemspider.com.
- 実験室安全のためのUCセンター(2013年1月18日)。標準操作手順水素化カルシウム。 chemengr.ucsb.eduから取得したもの:chemengr.ucsb.edu.


