水素化マグネシウムの化学式、化学構造および性質
の 水素化マグネシウム (MgH2 は、分子量7.66%の水素含有量を有する化合物であり、天然に白色結晶性固体として見出される。水素の潜在的な貯蔵媒体としても研究されてきたが、それは主に他の化学物質を調製するために使用される。.
それは、生理食塩水(またはイオン)水素化物のファミリーに属し、負に帯電したHイオンによって定義されるものです。これらの水素化物は、アルカリ金属およびアルカリ土類金属から形成されるものと考えられているが、マグネシウム(およびベリリウム)の場合には、このファミリーの水素化物を特徴付けるそれらのイオニクスに加えて、共有結合を有する。.
索引
- 1準備と処方
- 2化学構造
- 3物理的および化学的性質
- 3.1フィジカル
- 3.2化学物質
- 4つの用途
- 4.1水素貯蔵
- 4.2水素化と脱水素の反応
- 4.3泥
- 4.4燃料電池
- 4.5輸送とエネルギー
- 4.6アルキル化
- 5つのリスク
- 5.1水との反応
- 5.2自然発火性
- 6参考文献
準備と処方
水素化マグネシウムは、MgI触媒を用いた高温高圧(200気圧、500℃)の条件下での金属マグネシウム(Mg)の直接水素添加により生成します。2. その反応は以下と同等です。
Mg + H2→MgH2
MgHの生産も調査されています2 ボールミルで製造されたナノ結晶マグネシウムを使用して低温で.
他の調製方法もあるが、それらはより複雑な化学反応(マグネシウム - アントラセンの水素化、ジエチルマグネシウムと水素化リチウムアルミニウムとの反応、およびMgH錯体の生成物としての)を表す。2).
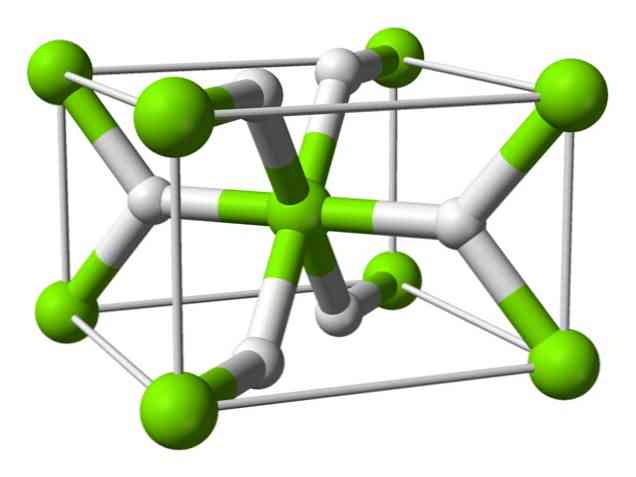
化学構造
この原子は室温で正方晶の結晶構造を持つルチルの構造をしています。それは高圧条件下で少なくとも4つの異なる形態を有し、そして水素不足を伴う非化学量論的構造もまた観察されている。後者は、形成されたときにごく少量の粒子でのみ生じる.
上記のように、ルチル構造中に存在する結合は、他の塩水化物のように、純粋にイオン性ではなく、部分的に共有結合の性質を有する。.
これにより、マグネシウム原子は完全にイオン化された球形になりますが、その水素化物イオンは細長い構造をしています。.
物理的および化学的性質
物理的
- 外観:白い結晶.
- 分子量:26.3209 g / mol
- 密度:1.45 g / cm3
- 融点:285℃で分解する
- 溶解度:水中で分解する.
この化合物は、26,321 g / molの分子量、1.45 g / cm 3の密度を有し、そして327℃の融点を有する。.
化学薬品
- 他の化学物質の製造のための前駆体.
- 可能性のあるエネルギー源としての水素貯蔵.
- 有機合成における還元剤.
この化合物を液体状態にすることはできないことを示すことが重要であり、それが運ばれるか、その融点を示すかまたは水中に導入されると、それは分解する。この水素化物はエーテルに不溶です.
それは非常に反応性がありそして非常に可燃性の物質でありそしてまた自然発火性である、すなわちそれは空気中で自然に発火することができる。この3つの条件は、この記事の最後のセクションで説明するセキュリティ上のリスクを表します。.
用途
水素貯蔵
水素化マグネシウムは、以下の化学反応により、水と容易に反応して水素ガスを生成します。
MgH2+2H2O→2H2+Mg(OH)2
さらに、この物質は以下のように287℃の温度と1barの圧力で分解する。
MgH2→Mg + H2
それ故、その使用および輸送のための水素貯蔵媒体としての水素化マグネシウムの使用が提案されている。.
ある量の金属マグネシウムの水素化および脱水素化は、ある量の気体状水素を輸送する方法として提案されているので、その輸送に漏れがないことを保証し、高圧容器を使用するよりも安全で実用的な方法を表す。.
水素化および脱水素反応
水素化マグネシウムの分解温度はその使用に対する制限要因であるが、水素化および脱水素化反応の速度論を改善するための方法が提案されてきた。これらのうちの1つはボールミルの使用によるマグネシウム粒子のサイズの減少とあります.
泥
加えて、所望の水素を得るために水と反応するであろう泥の形の水素化マグネシウム(粉末または他の固体粒子よりも扱いやすく安全である)を生成するシステムが提案されている。.
前述のスラッジは、細かく粉砕された水素化物によって形成され、油の保護層で保護され、分散剤に懸濁されて材料の損失なしに粘稠度を維持し、環境から水分を吸収しないようにすると推定される。.
このスラッジは、一般的なディーゼル、ガソリン、ウォーターポンプで汲み上げることができるという利点があり、この経済的な提案と効率的な.
燃料電池
水素化マグネシウムは、先進的な燃料電池の製造において、そしてまたバッテリーおよびエネルギー貯蔵の創出において実施することができる。.
輸送とエネルギー
過去数十年の間に、エネルギー源としての水素の使用が検討されてきた。水素を燃料として注入するには、安全で可逆的な貯蔵システムを見つけ、高い容積容量(単位体積あたりの水素量)と重量分析(単位質量あたりの水素量)が必要です。.
アルキル化
アルキル化(CHアルキル基を付加する)3R)塩基性媒体中の有機化合物の濃度、水素化物の融点よりも高い濃度および温度で-OH基が存在する.
この場合、水素化マグネシウム(MgH)に存在する水素2)、-OH基を結合して水を形成する。遊離マグネシウムは、炭化水素鎖に結合することを意図しているアルキル分子にしばしば付随するハロゲンを受け取ることができる.
リスク
水との反応
すでに述べたように、水素化マグネシウムは水と非常に簡単にそして激しく反応する物質であり、より高い濃度で爆発する能力を示している.
これは、その発熱反応が分解反応で放出された水素ガスを発火させるのに十分な熱を発生し、かなり危険な連鎖反応をもたらすために起こる。.
自然発火です
水素化マグネシウムは自然発火性でもあるため、湿った空気の存在下で自然発火し、酸化マグネシウムと水を生成する可能性があります。.
その吸入は、固体状態またはその蒸気と接触している状態では推奨されません。自然状態の物質およびその分解生成物は、重傷を負ったり死に至ることさえあります。.
それは水と接触してそれの汚染と腐食性の解決策を生成することができます。皮膚や目との接触はお勧めできません。また、粘膜に刺激を与える可能性があります。.
水素化マグネシウムが癌、生殖器系の欠陥、その他の肉体的または精神的影響などの慢性的な健康への影響を引き起こす可能性があることは証明されていませんが、取り扱いの際は保護具を着用することをお勧めします。細かい塵の性格).
この物質を取り扱うときは、空気の湿度を低く保ち、すべての発火源を消してドラム缶などの容器に入れて輸送する必要があります。.
爆発の可能性が大幅に低下するため、避けることができる場合は、常にこの物質を高濃度で使用することは避けてください。.
水素化マグネシウムがこぼれた場合は、作業場所を隔離し、ほこりを掃除機で集めてください。乾式掃除方法は絶対に使用しないでください。水素化物との反応の可能性を高めます.
参考文献
- Zumdahl、S. S.(1998)。ブリタニカ百科事典。 britannica.comから撮影.
- PubChem。 (2005)。 PubChemオープンケミストリーデータベース。 pubchem.ncbi.nlm.nih.govから取得.
- Safe Hydrogen、L.(2006)。グリーンカー会議greencarcongress.comから撮影.
- Chemicals、C。カメオケミカルズcameochemicals.noaa.govから取得.
- サービス、N.J。(1987)。ニュージャージー州保健省シニアサービス部。 nj.govから撮影.


