Histonasの特徴、構造、種類および機能
の ヒストン 真核生物の染色体を構成するクロマチン鎖を構成するヌクレオソーム形成のためにDNAと相互作用する塩基性タンパク質.
ヌクレオソーム、DNAとタンパク質によって形成された複合体は1974年に発見されました、そしてそれはクロマチン構成のこの基礎レベルを組み立てるヒストンです。しかしながら、ヒストンタンパク質の存在は1960年代以前から知られている。.
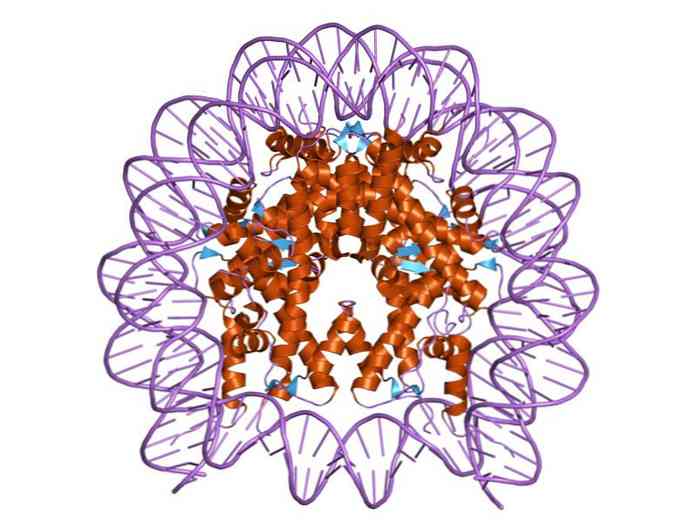
ヒストンは、DNA二重バンドが互いに密接に相互作用するこれらのタンパク質からなるタンパク質中心の周りに巻き付くように編成されている。ヒストン中心は円盤形をしており、DNAはその周りに約1.7回転します。.
多重水素結合は、各ヌクレオソーム中のヒストンによって形成されるタンパク質中心へのDNAの結合を可能にする。これらの結合は、主に、ヒストンのアミノ酸骨格とDNAの糖 - リン酸骨格との間に形成される。いくつかの疎水性相互作用およびイオン結合も参加しています.
「クロマチンリモデリング複合体」として知られるタンパク質は、ヌクレオソームに含まれるDNAへの転写機構の侵入を可能にする、DNAとヒストンとの間の分解および結合結合の形成を担う。.
ヒストンによって形成されるタンパク質中心への核酸の近接にもかかわらず、これらは、必要ならば、それらが転写因子および発現または遺伝子サイレンシングに関連する他のタンパク質の侵入を可能にするように配置される。.
ヒストンは複数の変異体を生成するさまざまな修飾を受けることができ、さまざまな方法で遺伝子発現を調節するという性質を持つ、さまざまな形のクロマチンの存在を可能にします。.
索引
- 1特徴
- 2つの構造
- 2.1ユニオンヒストン
- 3種類
- 3.1ヌクレオソームヒストン
- 3.2ユニオンヒストン
- 4つの機能
- 5参考文献
特徴
それらは自然界で最も保存されている真核生物タンパク質です。例えば、エンドウヒストンH4は、ウシタンパク質H4の102個のアミノ酸位置のうち2個のみが異なることが示されている。.
ヒストンは140個以下のアミノ酸を持つ比較的小さなタンパク質です。それらは塩基性アミノ酸残基に富んでいるので、それらは正の実効電荷を有し、これはマイナスの電荷を帯びた核酸との相互作用に寄与してヌクレオソームを形成する。.
ヌクレオソームおよび接合部または架橋ヒストンが知られている。ヌクレオソームヒストンはH 3、H 4、H 2 AおよびH 2 Bであり、結合ヒストンはH 1ヒストンファミリーに属する。.
ヌクレオソームの組み立て中に、特定の二量体H3-H4およびH2A-H2Bが最初に形成される。次に、2つのH 3 -H 4二量体が結合して四量体を形成し、続いてそれがH 2 A-H 2 B二量体と結合して八量体中心を形成する。.
全てのヒストンは主に細胞周期のS期の間に合成され、そしてヌクレオソームは複製フォークの直後に新生DNAヘリックスに組み立てられる。.
構造
ヒストンの一般構造は真核生物の間で塩基性アミノ酸領域と高度に保存された球状カルボキシル領域を含む.
2つのフォークでつながれて小さな疎水性中心を形成する3つのアルファヘリックスからなる「ヒストンフォールド」として知られる構造モチーフは、ヌクレオソームを構成するヒストン間のタンパク質間相互作用に関与しています。.
すべての真核生物において前記ヌクレオソームタンパク質の球状カルボキシルドメインを構成するのはこのヒストンの倍数である.
ヒストンはまた、長さが40アミノ酸以下の小さい「尾部」またはアミノ末端および他のカルボキシル末端領域(プロテアーゼに接近可能)を有する。両領域とも、複数の翻訳後共有結合修飾を受けることができる塩基性アミノ酸が豊富です.
ユニオンヒストン
真核生物では、それらの構造によって区別される、結合のヒストンの2つのファミリーがあります。いくつかは三部構造を有し、上記の球状ドメインはNおよびC末端の「非構造化」ドメインに隣接している。他の人はC末端ドメインしか持っていませんが.
ほとんどのヒストンは保存されているが、いくつかの特定の変異体は、いくつかの生物における胚形成または特殊化細胞の成熟の間に生じ得る。いくつかの構造上の変化は、以下のような翻訳後修飾と関係があります。
-リン酸化:クロマチンの凝縮度の変更に関連していると考えられており、セリン残基によく見られる.
-アセチル化:転写的に活性な染色体領域に関連する。通常、リジン残基の側鎖に存在します。これらの残基に生じると、正電荷が減少し、タンパク質とDNAとの親和性が低下する.
-メチル化:タンパク質コアから突き出ているリジン残基のモノ - 、ジ - またはトリ - メチラチオンとして与えることができる.
特定の酵素は、ヒストンにおけるこれらの共有結合修飾の原因である。これらの酵素には、ヒストンアセチルトランスフェラーゼ(HAT)、ヒストン - デアセチラーゼ複合体(HDAC)、ならびにヒストン - メチルトランスフェラーゼおよびデメチラーゼが含まれる。.
タイプ
ヒストンのキャラクタリゼーションは、弱カチオン交換樹脂をベースにしたクロマトグラフィーが際立っている、多様な生化学的技術によって行われてきました。.
何人かの著者は、真核生物において5つの主な種類のヒストンが区別される分類方法を確立している。 ±11.3kDaのF2A1またはFIV。 F2A2またはFIIbI、14.5kDa。分子量13.7 kDaのF2BまたはFIIb2、15.3 kDaのF3またはFIII.
FIグループを除いて、これらすべてのタイプのヒストンは細胞内で等モル量で見られます。.
同じ有効性を持ち、おそらく現在最も使用されている別の分類は、2つの異なるタイプのヒストン、すなわちヌクレオソームオクタマーの一部であるものと、それらの間でヌクレオソームを連結する接合または架橋ヒストンの存在を提案する。はい.
いくつかの変異体は種間でも起こり得、そして核ヒストンとは異なり、変異体は界面の間に合成され、そしてATPの加水分解から放出されるエネルギーに依存するプロセスを通して予め形成されたクロマチンに挿入される。.
ヌクレオソームヒストン
ヌクレオソームの核は、4つの構成的ヒストン:H2a、H2b、H3およびH4のそれぞれの対からなる。約145塩基対のDNAセグメントがラップされている.
ヒストンH4およびH2Bは、原則として、不変である。しかしながら、その生物物理学的および生化学的特性がヌクレオソームの通常の性質を変えるヒストンH3およびH2Aには、いくつかのバリエーションが明らかになっています。.
ヒトにおけるヒストンH2Aの変異体、H2A.Zタンパク質は大きな酸性領域を有し、それが関連するヒストンH3変異体に応じてヌクレオソームの安定性を支持することができる.
これらのヒストンは種間でいくらかの変動性を示しており、これは分子の最初の3分の1が非常に可変性であるヒストンH2Bのそれとは特別な場合である.
ユニオンヒストン
接合部または架橋ヒストンはクラスH1のヒストンである。これらはヌクレオソームと各粒子の始めと終わりに突き出ているDNA保護との間の結合の原因です。.
ヌクレオソームヒストンとは異なり、H1型のすべてのヒストンがヒストンの「折り畳み」の球状領域を有するわけではない。これらのタンパク質はヌクレオソーム間のDNAに結合し、転写的に言えば、より凝縮され活性の低い状態へのクロマチンのバランスの変化を促進する.
これらのヒストンは加齢、DNA修復、アポトーシスの過程と関連していると研究されているので、ゲノムの完全性の維持に重要な役割を果たしていると考えられています。.
機能
ヒストンのすべてのアミノ酸残基は、何らかの形でDNAとの相互作用に関与しています。これは、それらが真核生物の王国の間で非常に保存されているという事実を説明しています。.
クロマチンの形でのDNAのパッケージングにおけるヒストンの関与は、異なる細胞系統がそれらの遺伝子の転写機構への接近可能性を変えることによってのみ特殊化され得る複雑な多細胞生物にとって非常に関連性がある。.
転写活性のあるゲノム領域はヌクレオソームが緻密であることから、DNAとヒストンタンパク質との会合はそれらの転写の負または正の調節にとって極めて重要であることが示唆される。.
同様に、細胞の生涯を通じて、内部と外部の両方の多数の刺激に対する反応は、クロマチンのわずかな変化に依存しています。これは通常、翻訳後のリモデリングとヒストンの修飾に関係しています。 DNAとの密接な関係.
真核生物において複数のヒストン変数が異なる機能を発揮する。それらのうちの1つは、有糸分裂中の染色体の分離に関与する動原体構造の形成におけるヒストンH3の変異体の関与と関係がある.
他の真核生物におけるこのタンパク質の対応物は、有糸分裂および減数分裂の間に紡錘体微小管が結合するタンパク質動原体の集合に必須であることが示されている。.
参考文献
- Alberts、B.、Johnson、A.、Lewis、J.、Morgan、D.、Raff、M.、Roberts、K.、およびWalter、P.(2015)。細胞の分子生物学(第6版)。ニューヨーク:ガーランドサイエンス.
- Campos、E. I.、およびReinberg、D.(2009)。ヒストン:クロマチンに注釈を付ける。アンヌ。 Rev. Genet。、43、559-599.
- ハーヴェイ、A.C。、&ダウンズ、J.A。(2004)。リンカーヒストンにはどのような機能がありますか? Molecular Microbiology、53、771-775.
- Henikoff、S.、&Ahmad、K.(2005)。変異ヒストンのクロマチンへの集合アンヌ。牧師セル。 Dev。Biol。、21、133-153.
- Isenberg、I。(1979)。ヒストンアンヌ。 Rev.Biochem。、48,159−191。.
- Kornberg、R. D.、&Thomas、J. O.(1974)。クロマチン構造ヒストンのオリゴマーScience、184(4139)、865-868.
- Smith、E.、DeLange、R.、&Bonner、J.(1970)。ヒストンの化学と生物学生理学的レビュー、50(2)、159-170.


