ボーア特性の原子モデル、仮定、限界
の ボーアの原子模型 はデンマークの物理学者Neils Bohr(1885-1962)によって提案された原子の表現です。このモデルは、電子が原子核の周りを一定の距離を周回する軌道を描いていることを示しています。軌道 - あるいは彼が呼んだようなエネルギー準位 - は異なるエネルギーのものです.
電子が軌道を変えるたびに、「量子」と呼ばれる一定量のエネルギーを放出または吸収します。ボーアは、水素原子によって放出された(または吸収された)光のスペクトルを説明した。電子がある軌道から別の軌道へと核に向かって移動すると、エネルギーの損失があり、波長とエネルギーの特性を持つ光が放出されます。.

ボーア氏は、電子が原子核に近いほどそのエネルギー状態が低いことを考慮して、電子のエネルギー準位を数えた。このように、電子が核から離れるほど、エネルギー準位数は大きくなり、したがってエネルギー状態は高くなる。.
索引
- 1主な特徴
- 1.1それは当時の他のモデルと理論に基づいています
- 1.2実験的証拠
- 1.3電子はエネルギー準位に存在する
- 1.4エネルギーがなければ電子の動きはない
- 1.5各層の電子数
- 1.6電子はエネルギーを放射せずに円軌道で回転する
- 1.7許容軌道
- 1.8ジャンプで放出または吸収されたエネルギー
- 2ボーア原子モデルの仮定
- 2.1最初の仮定
- 2.2 2番目の仮定
- 2.3 3番目の仮定
- 3水素原子のエネルギー準位図
- 4ボーア模型の3つの主な制限
- 5興味のある記事
- 6参考文献
主な特徴
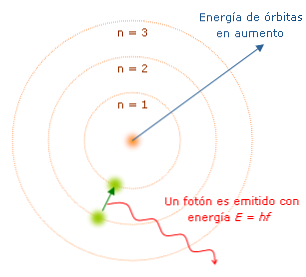
ボーアモデルの特性は、より完全な原子モデルの開発への道を決定するので重要です。主なものは以下のとおりです。
それは当時の他のモデルと理論に基づいています
ボーアのモデルは、ラザフォードの原子モデルによって支持された量子論とアルバートアインシュタインの光電効果から得られたアイデアを組み込んだ最初のものであった。実際、アインシュタインとボーアは友達だった.
実験的証拠
このモデルによれば、原子が許容軌道の間を飛び越えたときにのみ、原子は放射線を吸収または放出する。ドイツの物理学者ジェームズ・フランクとグスタフ・ヘルツは1914年にこれらの状態の実験的証拠を得ました.
電子はエネルギー準位に存在する
電子は核を取り囲み、特定のエネルギーレベルで存在します。エネルギーレベルは離散的で、量子数で表されます。.
これらの準位のエネルギー値は、主量子数と呼ばれる数nの関数として存在します。これは、後で詳しく説明する方程式で計算することができます。.
エネルギーがなければ、電子の動きはありません。
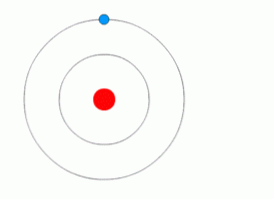
上の図は、量子ジャンプを起こす電子を示しています.
このモデルによれば、エネルギーがなければ電子があるレベルから別のレベルに移動することはありません。エネルギーがないと2つの磁石が落ちたり離れたりした物体を持ち上げることは不可能です。.
ボーアは、量子があるレベルから別のレベルへ進むために電子が必要とするエネルギーとして提案しました。彼はまた、電子が占める最低のエネルギー準位は「基底状態」と呼ばれると述べた。 「励起状態」は、電子がより高いエネルギーの軌道へと通過することから生じる、より不安定な状態である。.
各層の電子数
各層に収まる電子は2nで計算されます。2
周期表の一部であり、同じ列にある化学元素は、最後の層で同じ電子を持っています。最初の4つの層の中の電子の数は2、8、18と32になります。.
電子はエネルギーを放射することなく円軌道で回転します
ボーアの第一仮説によれば、電子はエネルギーを放射することなく原子の核の周りの円軌道を描く.
許容される軌道
ボーアの第2の仮説によれば、電子に許される唯一の軌道は、電子の角運動量Lがプランク定数の整数倍である軌道です。数学的には次のように表現されています。
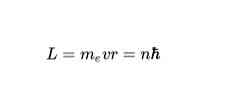
ジャンプで放出または吸収されたエネルギー
第3の仮説によれば、電子はある軌道から別の軌道へのジャンプでエネルギーを放出または吸収します。軌道のジャンプでは光子が放出または吸収され、そのエネルギーは数学的に表されます。
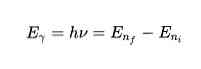
ボーア原子モデルの仮定
ボーアは、太陽の周りの惑星と同様に、正に帯電した原子核の周りを電子が回転するという、それに従って原子の惑星モデルに連続性を与えました。.
しかし、このモデルは古典物理学の仮説の1つに挑戦しています。これによると、円形経路を移動する電荷(電子のような)を持つ粒子は、電磁放射の放出によってエネルギーを連続的に失うはずです。エネルギーを失うと、電子は核に落ちるまでらせんに従わなければなりません.
ボーアはそれから、古典物理学の法則は原子で観察された安定性を記述するのに最も適していないと仮定して、そして彼は以下の3つの仮説を提示しました:
最初の仮説
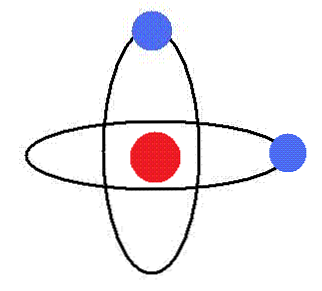
電子は、エネルギーを放射することなく、周回軌道で核の周りをスピンします。これらの軌道では、軌道角運動量は一定です。.
原子の電子に対しては、特定の定義されたエネルギーレベルに対応して、特定の半径の軌道のみが許可されます。.
第二仮説
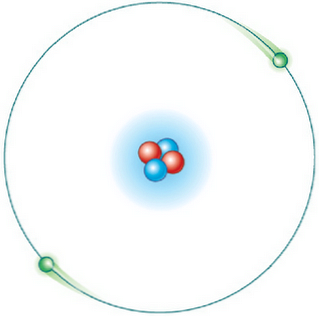
すべての軌道が可能なわけではありません。しかし、電子が許容される軌道に入ると、それは特定の一定のエネルギーの状態になり、エネルギーを放出しません(定常エネルギー軌道)。.
たとえば、水素原子では、電子の許容エネルギーは次の式で与えられます。
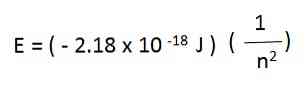
上式から生成される水素原子の電子エネルギーは、nの各値に対して負です。 nが増加すると、エネルギーは負になることが少なくなるため、増加します。.
nが十分に大きい場合、例えば、n =∞-エネルギーはゼロであり、電子が放出されてイオン化原子であることを表します。ゼロエネルギーのこの状態は、負のエネルギーを持つ状態よりも大きなエネルギーを持っています.
第三の仮説
電子は、エネルギーを放出または吸収することによって、静止エネルギー軌道から別の軌道に変わることができます。.
放出または吸収されるエネルギーは、2つの状態間のエネルギー差に等しくなります。このエネルギーEは光子の形をしており、次式で与えられる。
E = h ν
この式で、Eはエネルギー(吸収または放出)、hはプランク定数(その値は6.63 x 10です)-34 ジュール秒[J-s])、νは光の周波数で、単位は1 / s.
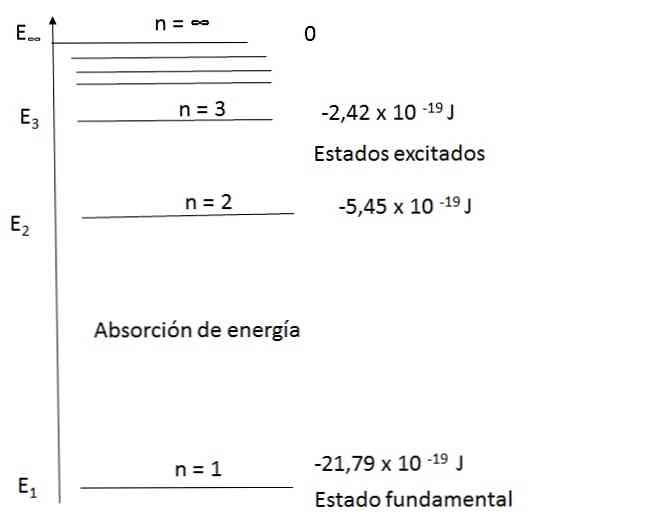
水素原子のエネルギー準位図
ボーア模型は水素原子のスペクトルを十分に説明することができた。例えば、可視光の波長域において、水素原子の発光スペクトルは以下の通りである。
観測されたいくつかの光帯の周波数を計算する方法を見てみましょう。たとえば、赤の色.
最初の式を使用し、2と3をnに置き換えると、図に示される結果が得られます。.

それは:
n = 2の場合、E2 = -5.45×10-19年 J
n = 3の場合、E3 = -2.42×10-19年 J
2つのレベルのエネルギー差を計算することが可能です。
ΔE= E3 - E2 =(-2.42 - ( - 5,45))x 10 - 19年 = 3.43×10 - 19年 J
第3の仮説で説明した式によれば、ΔE = hνである。それから、ν(光の周波数)を計算することができます。
ν=ΔE/ h
それは:
ν= 3.43 x 10-19年 J / 6.63×10-34 J-s
ν= 4.56 x 1014年 の-1 または4.56×1014年 Hz
λ= c /νであり、光速c = 3 x 10 8 m / s、波長は
λ= 6,565×10 - 7 m(656.5 nm)
これは水素線のスペクトルで観察される赤いバンドの波長値です.
ボーア模型の3つの主な制限
1 - 水素原子のスペクトルには適応しますが、他の原子のスペクトルには適応しません.
2 - 電子の波動特性は、原子核の周りを回転する小さな粒子としてこれの説明に表されていません.
3-ボーアはなぜ古典的な電磁気学が彼のモデルに当てはまらないのか説明できない。つまり、電子が静止軌道にあるときになぜ電子は電磁放射を放出しないのか.
興味のある記事
シュレディンガー原子モデル.
Broglieの原子モデル.
チャドウィックの原子モデル.
ハイゼンベルグの原子モデル.
ペリンの原子モデル.
トムソンの原子モデル.
ダルトンの原子モデル.
Dirac Jordanの原子モデル.
デモクリトスの原子モデル.
参考文献
- Brown、T. L.(2008)。化学:中心科学アッパーサドルリバー、ニュージャージー州:ピアソンプレンティスホール
- Eisberg、R.、&Resnick、R.(2009). 原子、分子、固体、核、および粒子の量子物理. ニューヨーク:ワイリー
- ボーアゾンマーフェルトの原子模型取得元:fisquiweb.es
- Joesten、M.(1991)。化学の世界ペンシルベニア州フィラデルフィア:Saunders College Publishing、pp.76-78.
- モデル・ド・ボーア・ド・ラトーム・ハイドロジェン。 fr.khanacademy.orgから取得
- イズラー、K.回顧展シュルレトーム:lemodèlede Bohr 1セント回答。取得元:home.cern



