Broglie原子モデルの特性と制限
の ブロイ原子モデル 彼は1924年にフランスの物理学者ルイス・ブロイによって提案されました。彼の博士論文で、ブロイは電子の波 - 粒子双対性を主張し、波力学の基礎を築きました。 Broglieは、原子スケールで物質の波動粒子の性質に関する重要な理論的発見を発表しました.
その後、1927年に、科学者クリントンデイビスソンとレスターゲルマーによってブロイリーの記述が実験的に実証されました。.
Broglieは、物質が光の振る舞いに似た振る舞いをしている可能性を発表し、電子のような素粒子でも似たような性質を示唆しました。.
電荷と軌道は、電子によって表される波の振幅、長さ、および周波数を制限します。 Broglieは原子核の周りの電子の動きを説明した.
索引
- 1 Broglie原子モデルの特徴
- 2デイビスソンとゲルマーの実験
- 3制限
- 4興味のある記事
- 5参考文献
Broglie原子モデルの特徴
彼の提案を発展させるために、Broglieは電子が光と同じように波と粒子の間に二重の性質を持っていたという原理から始めました.
この意味で、Broglieは両方の現象の比較を行い、そして光の波動性の研究のためにEinsteinによって開発された方程式に基づいて、彼は以下を示しました:
- 光子の全エネルギー、ひいては電子の全エネルギーは、波の周波数とプランク定数(6.62606957(29)×10)の積から得られます。 -34 次の式で詳しく説明されているとおり、Jules(seconds)
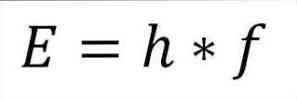
この表現では:
E =電子エネルギー.
h =板定数.
f =波の周波数.
- 光子、したがって電子の線形モーメントは波長に反比例し、両方の大きさはプランク定数によって関係付けられます。
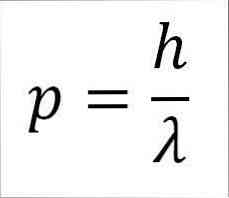
この表現では:
p =電子の線形モーメント.
h =板定数.
λ=波長.
- 線形運動量は、粒子の質量と変位中に粒子が持つ速度との積です。.
前の数式が波長の関数として再構成されていると、次のようになります。
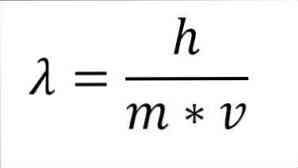
その表現では:
λ=波長.
h =板定数.
m =電子の質量.
v =電子速度.
プランク定数hは小さい値なので、波長λもそうです。その結果、電子の波動特性は原子レベルと原子レベルでのみ発生すると言えるでしょう。.
- Broglieはボーアの原子モデルの仮定にも基づいています。後者によれば、電子の軌道は制限されており、整数の倍数にしかなり得ない。したがって:
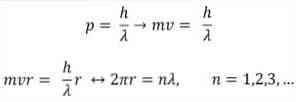
どこで:
λ=波長.
h =板定数.
m =電子の質量.
v =電子速度.
r =軌道の半径.
n =整数.
Broglieが基礎として採用したボーア原子モデルによれば、電子が定在波のように振舞う場合、唯一の許容される軌道は半径が波長λの整数倍に等しい軌道である.
したがって、すべての軌道が電子の移動に必要なパラメータを満たしているとは限りません。それが、電子が特定の軌道でしか移動できない理由です。.
Broglie電子の波動理論はボーア原子モデルの成功を正当化して水素原子の単一電子の振る舞いを説明した.
同様に、なぜこのモデルがより複雑な系、すなわち複数の電子を持つ原子に適合しなかったのかについても解明されました。.
デイビスソンとゲルマーの実験
Broglie原子モデルの実験的検証は、出版から3年後の1927年に行われました。.
著名なアメリカの物理学者クリントンJ.デイビスソンとレスターゲルマーは実験的に波力学の理論を確認した.
DavissonとGermerは、ニッケル結晶を通して電子ビームの散乱試験を行い、金属媒体を通して回折現象を観察しました。.
実施した実験は以下の手順を実施することからなった。
- 最初の例では、既知の初期エネルギーを持つ電子ビームを含むアセンブリが配置されました.
- 電位差を促して、電子の移動を加速するために電圧源が設置されました.
- 電子ビームの流れは金属結晶に向けられた。この場合、ニッケル.
- ニッケル結晶に衝突した電子数を測定した。.
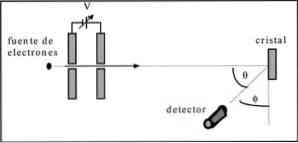
実験の終わりに、DavissonとGermerは電子が異なる方向に分散していることを検出しました。.
異なる方位の金属結晶を使用して実験を繰り返すことによって、科学者たちは以下のことを発見しました:
- 金属結晶を通る電子ビームの分散は光線の干渉および回折の現象と同程度であった。.
- 衝撃結晶上の電子の反射は、理論的には、Broglieの電子波の理論に従って記述されるべき軌道を記述した。.
合成において、DavissonとGermerの実験は実験的に電子の二重波 - 粒子性質を証明した。.
制限事項
Broglie原子モデルはそれが動く軌道上の電子の正確な位置を予測しない.
このモデルでは、電子は特定の場所を使わずに軌道の周りを移動する波として認識されます。これは電子軌道の概念を導入します。.
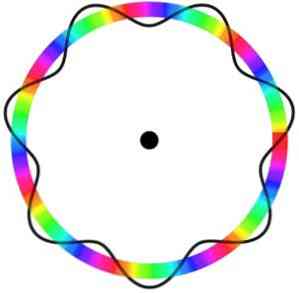
さらに、シュレディンガーのモデルに似たBroglie原子モデルは、その軸上での電子の回転を考慮していません。回る).
電子の固有の角運動量を無視することによって、これらの素原子粒子の空間的変動は無視されています。.
同じ順序で、このモデルは相対論的効果の結果としての高速電子の振る舞いの変化を考慮に入れていません。.
興味のある記事
シュレディンガー原子モデル.
チャドウィックの原子モデル.
ハイゼンベルグの原子モデル.
ペリンの原子モデル.
トムソンの原子モデル.
ダルトンの原子モデル.
Dirac Jordanの原子モデル.
デモクリトスの原子モデル.
ボーアの原子モデル.
参考文献
- ボーアの量子論とドブロイ波(s.f.)取得元:ne.phys.kyushu-u.ac.j
- ルイドブロイ - 伝記(1929)。 ©ノーベル財団。以下から取得しました:nobelprize.org
- ルイ=ヴィクトル=ド=ブロイ(s.f.)。取得元:chemed.chem.purdue.edu
- Lovett、B(1998)。ルイドブロイ。百科事典Britannica、Inc.取得元:britannica.com
- De Broglieの原子モデル遠距離教育の国立大学。スペイン取得元:ocw.innova.uned.es
- ルイ・ド・ブロイの物質の波(s.f.)。取得元:hiru.eus
- フォン・パメル、O。およびマーチィシオ、S。量子力学ロザリオ国立大学。取得元:fceia.unr.edu.ar


