ダルトン仮説の原子モデル
の ダルトンの原子モデルまたは ダルトンの原子論, それはイギリスの化学者そして数学者ジョン・ダルトンによって1803年から1807年の間に提出された提案でした。これは原子の構造と機能に関する概念的組織の最初の提案でした.
ダルトンモデルは、原子が不可分の中実でコンパクトな球であるという事実を提案しているため、球形モデルとしても知られています。このモデルのおかげで、化学についての説明を世界の他の国々に提供することがはるかに容易になり、それが続いた多くの革新的な研究プロジェクトの基礎となりました。物質が特定の状態で反応した理由を説明できる.
ダルトンによれば、物質はatomと呼ばれる最小単位で構成されており、破壊することも分割することもできません。以前Democritusと彼のメンターLeucipoによって提案されたこのユニットは、ダルトンの研究と彼の原子モデルの作成の基礎となった.
この原子論で、ジョン・ダルトンは原子の存在に関するギリシャの哲学者の考え(宇宙の原子論)を取り上げようとしましたが、彼の考えを実証することを可能にした様々な実験室実験をプラットフォームとして使用しました.
索引
- 1ダルトン原子モデルの仮説
- 1.1仮定1
- 1.2仮定2
- 1.3仮定3
- 1.4仮説4
- 1.5仮定5
- 1.6仮説6
- ダルトンの原子モデルの2つの誤差
- 2.1水フォーミュラ
- 2.2原子の組成
- 3結論
- 4ダルトンの主な貢献
- 4.1原子論の先駆者
- 4.2彼は現代化学の基礎を築いた
- 4.3化学量表を最初に公開する
- 4.4色覚異常に名前を付ける
- 5興味のある記事
- 6参考文献
ダルトン原子モデルの仮定
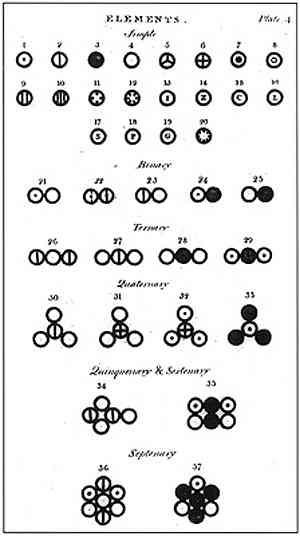
ダルトンは6つの仮説を用いて彼の原子モデルを定式化し、その中で彼は彼がどのようにして彼の研究をベースにしそして彼がそれらを実行したかを説明します.
仮説1

上の画像では、ダルトンのモデルの要約が表示されています。原子は、分割できず、壊れにくく、均質な小さな球になります。.
ダルトンの最初の仮説は、元素は原子と呼ばれる小さな粒子でできていると述べています。.
また、ダルトンは、これらの粒子はいかなる化学反応でも変化することができないとコメントした.
仮説2

ダルトンの2番目の仮説は、同じ元素に含まれるすべての原子は他の特性と同じ重量であることを立証しました.
他方では、それはまた、異なる元素の原子が異なる質量を有することを立証した。この提案から、異なる元素を水素と比較したときに実証された相対原子量の知識が生まれました。.
仮説3

ダルトンの3番目の仮説は、原子が化学反応で結合しても不可分であることを立証しました。それらは創造されたり破壊されたりすることもできません。.
等しいものと異なるものの両方の原子の組み合わせは、より複雑な化合物を生成しますが、このプロセスは、原子が物質の最小単位であるという事実を変えません.
仮説4
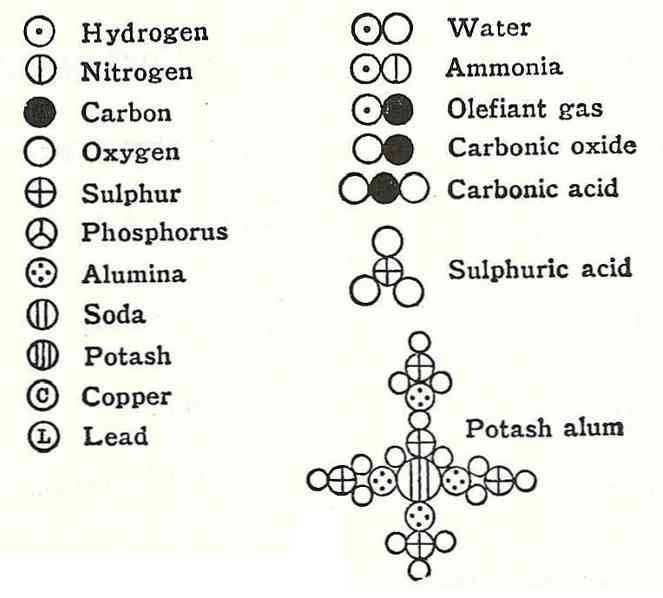
ダルトンの4番目の仮説は、原子が結合して化合物を形成したとしても、それらは常に単純で完全な数で表現できる関係を持つことを立証した。原子は分割できないので、この式は小数では表示されません。.
仮説5
ダルトンの5番目の仮説は、複数の化合物を形成するために、異なる比率で異なる原子の可能な組み合わせがあると述べた.
このように、有限の量の原子から、宇宙に存在するすべての物質がやって来たということが説明できます。.
仮説6
ダルトンの6番目と最後の仮説は、それぞれすべての化合物は2つ以上の異なる元素の原子の組み合わせから作られたと述べています.
ダルトン原子モデルの誤差
科学の世界におけるすべての理論のように、ダルトンによって提案されたモデルに関して多くの反論がありました、それはダルトンの革新的な考えを残して長年にわたって実証されました.
水フォーミュラ
この一例は、ダルトンが水の公式に関して与えた議論であり、彼はそれが水素と酸素で構成されていたと言った.
この記述のために、その情報に基づいていたいくつかの塩基性化合物の質量と重量に関して計算の多くのエラーがありました.
数年後、ヨーロッパの科学者Gay-LussacとAlexander von Humbodtはこの情報に反論し、水が実際には2つの水素と1つの酸素からなることを証明しました。 6年後、Amadeo Avogadroは水の正確な組成を指摘し、それが原因でAvogadroの法則があります。.
原子の組成
一方、20世紀には原子の真の組成が明らかにされました。この場合、陽子、電子、中性子などの小さな単位があることが示されました。.
同様に、メンデレーエフとマイヤーの周期律表に確立された異なる原子量の存在、同位体の存在、そしてより具体的な化学的性質が現れました。.
結論
彼の誤りにもかかわらず、ジョン・ダルトンの貢献は科学の世界で非常に関連性があり、彼が提供した大量の情報のために彼の時代をかき立てました。.
あなたの科学的貢献はまだ有効であり、まだ研究中です.
ダルトンの原子モデルは、科学の世界での関連性と、科学の歴史の中で現時点で提示された調査と仮説への正しい説明のために、何十年も疑問視されていませんでした。.
ダルトンの主な貢献
科学の世界への彼の貢献は主に定量的テストを通して自然についての仮説を明確にし、定式化することでした.
科学者は、1884年7月27日にマンチェスターで、そして君主制から名誉を受けた直後に心臓発作で死亡した.
原子論の先駆者
John Daltonはイギリスの化学者、数学者および化学者でした。彼は1766年9月6日にイギリスのカンバーランドで生まれ、彼が彼の原子モデルを提示した瞬間から原子理論の前駆体の一つとして知られています。.
彼は現代化学の基礎を築いた
ダルトンは、化学元素の相対重量の表を作成するための先駆者の一人として知られています。この事実は、私たちが現代の化学として今日知っていることの基礎を築くのに役立ちました.
化学量表を最初に公開する
ダルトンは、水素、酸素、リン、炭素、硫黄などの元素を含む原子量の表を出版したことを光栄に思った最初の科学者です。この出版物のおかげでダルトンは働き始め、彼のアトミックモデルとなるものを造形し始めた。.
色覚異常に名前を付ける
ダルトンは色をとらえるために視覚的な問題で登録された最初の人々の一人であり、彼のためにこの状態は色覚異常と呼ばれていることに注意すべき.
興味のある記事
シュレディンガー原子モデル.
Broglieの原子モデル.
チャドウィックの原子モデル.
ハイゼンベルグの原子モデル.
ペリンの原子モデル.
トムソンの原子モデル.
Dirac Jordanの原子モデル.
デモクリトスの原子モデル.
ボーアの原子モデル.
参考文献
- ダルトンの原子論2017年11月24日、Khanacademyから取得:www.khanacademy.org
- ダルトンの原子論2017年11月24日、インディアナ大学ノースウエスト大学から取得:iun.edu
- 原子論2017年11月24日、ブリタニカ百科事典より取得:www.britannica.com
- 原子論2017年11月24日、ウィキペディアから取得:en.wikipedia.org
- 原子構造の歴史2017年11月24日、ルーメンから取得:course.lumenlearning.com.


