化学方程式のバランスをとる方法と例
の 化学方程式のバランス 上記式に存在する全ての元素は、各側に同数の原子を有することを意味する。これを達成するためには、反応中に存在するそれぞれの種に適した化学量論係数を割り当てるために平衡化法を使用することが必要である。.
化学方程式とは、2つ以上の物質間の化学反応の過程で起こることを記号で表したものです。反応物は互いに相互作用し、そして反応条件に応じて、1種以上の異なる化合物が生成物として得られるであろう。.
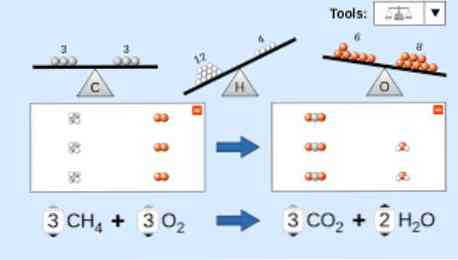
化学式を記述するときは、次のことを考慮する必要があります。最初に、反応物質が式の左側に書かれ、続いて、実行される反応の種類に応じて、一方向の矢印または2つの反対方向の水平矢印が続きます。ケープ.
索引
- 1化学方程式のバランスをとる方法
- 1.1試行錯誤による化学方程式のバランス(検査または試行による)
- 1.2化学方程式の代数バランシング
- 1.3酸化還元方程式のローリング(イオン - 電子法)
- 2化学方程式のバランスをとる例
- 2.1最初の例
- 2.2 2番目の例
- 2.3 3番目の例
- 3参考文献
化学方程式のバランス方法
反応物および生成物が知られていること、およびそれらの式がそれらに対応する側で正しく表現されていることを基礎として、我々は以下の方法に従って式のバランスをとることに進む。.
試行錯誤による化学方程式のバランス(検査または試行によっても呼ばれます)
これは反応の化学量論に基づいており、両側で各元素の同数の原子が得られる最小の可能な整数が選択される限り、方程式を均衡させるために異なる係数で試みることを試みる。反応の.
反応物または生成物の係数はその式の前にある数であり、式の添え字を変更すると化合物の正体が変わるため、式のバランスをとるときに変更できる唯一の数です。問題の.
カウントして比較する
反応の各要素を特定し、それを正しい側に配置した後、方程式に存在する各要素の原子数を数えて比較し、バランスをとる必要があるものを決定します。.
次に、バランスの取れていない要素を含む各式の前に係数全体を配置して、各要素のバランスをとります(一度に1つずつ)。通常、金属元素が最初にバランスが取られ、次に非金属元素がバランスが取られ、最後に酸素原子と水素原子がバランスが取られます。.
このようにして、各係数は前述の式のすべての原子を掛けます。それで、要素をバランスさせている間、他はアンバランスになることができます、しかし、反応がバランスをとられるので、これは修正されます.
最後に、方程式全体が正しく均衡していること、つまり物質の保存則に従っていることが最後の計算によって裏付けられています。.
化学方程式の代数バランシング
この方法を使用するために、解かなければならない系の未知数として化学方程式の係数を扱うための手順が確立されている。.
まず、反応の特定の要素を基準とし、係数を各分子内のその要素の既存の原子に従って、未知数を表す文字(a、b、c、d ...)として配置します。種が含まれていないその要素が "0"に配置されている).
この第一式を得た後、反応中に存在する他の元素についての式が決定される。反応に含まれる要素の数と同じ数の方程式があります.
最後に、未知数は、縮小、等化、または置換の代数的方法の1つによって決定され、係数が得られます。これにより、結果は正しく平衡化された方程式になります。.
酸化還元方程式のバランス(イオン - 電子法)
最初に、一般的な(不均衡な)反応がそのイオン型で行われます。それから、この方程式は二つの半反応、酸化と還元に分けられ、それぞれ原子の数、それらのタイプとこれらの電荷によってバランスをとります。.
例えば、酸性媒体中で起こる反応のために、H分子が添加される。2酸素原子のバランスをとり、Hを加える+ 水素原子のバランスをとる.
対照的に、アルカリ性媒体中では、同数のOHイオンが添加される。- 各Hイオンの方程式の両側に+, そしてHイオンが発生する場所+ そしてOH- それらは一緒になってH分子を形成します2○.
電子を追加
それから、各半反応で物質のバランスを取った後、電荷をバランスさせるのに必要なだけの電子を追加しなければなりません。.
各半反応の回転に続いて、これらは、試行錯誤によって最終方程式を均衡させることによって追加され、そして頂点に達する。 2つの半反応の電子数に違いがある場合は、一方または両方にこの数に等しい係数を掛けなければなりません。.
最後に、この方程式には、大域方程式の両側に同じ電荷があることに加えて、同じ数の原子と同じタイプの原子が含まれていることを裏付ける必要があります。.
化学方程式のバランスをとる例
最初の例
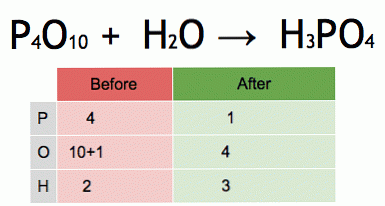
これはバランスの取れた化学方程式のアニメーションです。五酸化リンと水はリン酸に変換されます.
P 4 O 10 + 6 H 2 O→4 H 3 PO 4(-177 kJ).
2番目の例
エタンの燃焼反応があります(アンバランス).
C2H6 + ○2 →CO2 + H2○
それをバランスさせるために試行錯誤の方法を用いて、いずれの元素も方程式の両側に同じ数の原子を有さないことが観察される。したがって、それは製品の側面でそれに付随する化学量論的係数として2を加える、炭素収支から始まります.
C2H6 + ○2 →2CO2 + H2○
炭素は両側でバランスがとれているので、水分子に3を加えることで水素のバランスを取ります。.
C2H6 + ○2 →2CO2 + 3H2○
最後に、方程式の右側に7つの酸素原子があり、それがまだバランスが取れていない最後の要素であるので、7/2の分数は酸素分子の前に置かれます(全体の係数が一般に好ましいです).
C2H6 + 7 / 2O2 →2CO2 + 3H2○
次に、方程式の両側に同じ数の炭素原子(2)、水素(6)、酸素(7)があることを確認します。.
3番目の例
重クロム酸イオンによる鉄の酸化は酸性媒体中(不均衡かつそのイオン形態)で起こる.
信仰2+ + Cr2○72- →信仰3+ + Cr3+
その平衡化のためにイオン - 電子法を用いて、それは二つの半反応に分けられる。.
酸化:信仰2+ →信仰3+
還元:クロム2○72- →Cr3+
鉄原子はすでにバランスが取れているので(1:1)、電荷のバランスをとるために電子が生成物の側面に追加されます。.
信仰2+ →信仰3+ + e-
これでCrの原子はバランスがとれ、方程式の右辺に2が加算されます。次に、反応が酸性媒体中で起こるとき、7個のH分子が加えられる。2または酸素原子のバランスをとるために製品の側面に.
Cr2○72- →2Cr3+ + 7H2○
H原子のバランスをとるために、14個のHイオンが添加される。+ 反応物側で、材料を均一化した後、同じ側に6つの電子を追加することで電荷のバランスを取ります。.
Cr2○72- +14時間+ + 6e- →2Cr3+ + 7H2○
最後に、両方の半反応が追加されますが、酸化反応には電子が1つしかないため、これらすべてに6を掛ける必要があります。.
6Fe2+ + Cr2○72- +14時間+ + 6e- →信仰3+ + 2Cr3+ + 7H2O + 6e-
最後に、電子は大域イオン方程式の両側で除去されなければならず、それらの電荷と物質が正しく釣り合っていることを検証します。.
参考文献
- Chang、R.(2007)。化学(第9版)。マッグロウヒル.
- Hein、M。、およびArena、S(2010)。カレッジケミストリーの基礎、代替。 books.google.co.veから取得
- Tuli、G. D.およびSoni、P. L.(2016)。化学または化学方程式の言語books.google.co.veから取得
- スピーディーな出版(2015)化学方程式と答え(迅速な研究ガイド) books.google.co.veから取得


