臭化水素酸(HBr)の構造、性質、形成、用途
の 臭化水素酸 臭化水素と呼ばれるガスの水溶液から生じる無機化合物です。その化学式はHBrであり、さまざまな方法で等価と考えることができます。つまり、ヒドラジド.
化学式では、臭化水素酸であってガスではないことを示すために、HBr(ac)と表記する必要があります。この酸は、塩酸HClよりもさらに強力な、最も知られているものの1つです。これに対する説明はその共有結合の性質にある.
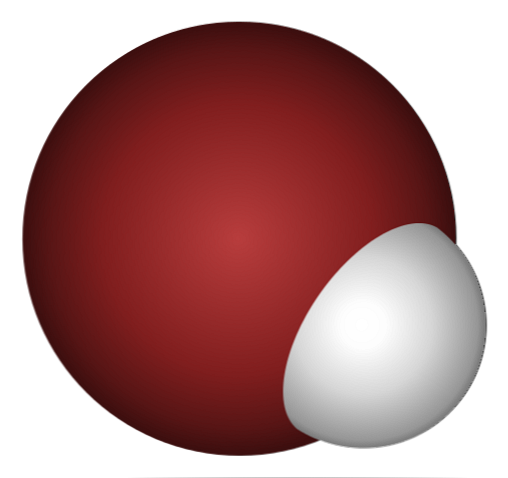
なぜHBrはそのような酸であり、さらに水に溶けるのですか? Hの1s軌道とBrの4p軌道の重なりが小さいため、共有結合H-Brは非常に弱いため.
上の画像をよく見ると、これは驚くことではありません。明らかに臭素原子(茶色)が水素原子(白)よりはるかに大きいです。.
その結果、いかなる妨害もH-Br結合の破壊を引き起こし、Hイオンを放出する。+. そして、臭化水素酸はプロトンまたは水素イオンを移動させるので、ブレンステッド酸である。その強さはそれがいくつかの有機臭素化化合物(1-ブロモエタン、CHのような)の合成に使われるようなものです。3CH2Br).
臭化水素酸は、水酸基の後、HIで、特定の固体サンプルの消化に最も強力で最も有用な塩酸塩の1つです。.
索引
- 1臭化水素酸の構造
- 1.1酸度
- 2物理的および化学的性質
- 2.1分子式
- 2.2分子量
- 2.3外観
- 2.4臭い
- 2.5臭気閾値
- 2.6密度
- 2.7融点
- 2.8沸点
- 2.9水への溶解度
- 2.10蒸気密度
- 2.11 pKaの酸性度
- 2.12カロリー容量
- 2.13標準モルエンタルピー
- 2.14標準モルエントロピー
- 2.15引火点
- 3命名法
- 4形成はどうですか?
- 4.1水中の水素と臭素の混合物
- 4.2三臭化リン
- 4.3二酸化硫黄と臭素
- 5つの用途
- 5.1臭化物の調製
- 5.2ハロゲン化アルキルの合成
- 5.3触媒
- 6参考文献
臭化水素酸の構造
H-Brの構造は画像に示されており、その特性と特性は、ガスのものであっても、その水溶液と密接に関係しています。そのため、2つの化合物のどちらがほのめかしているのかについて混乱するようになる点があります。HBrまたはHBr(ac).
HBr(ac)の構造は、今や水分子がこの二原子分子を溶媒和しているので、HBrのそれとは異なる。それが十分近くなると、Hが転送されます+ Hの分子に2または、次の化学式に示すように
HBr + H2O => Br-- + H3○+
したがって、臭化水素酸の構造はBrイオンからなる-- とH3○+ 静電的に相互作用します。今、それはH-Brの共有結合とは少し異なります.
その大きな酸性度はかさばる陰イオンBrによるものです。- Hとほとんど対話できない3○+, 彼がHを譲渡するのを防ぐことができない+ 他の周辺の化学種へ.
酸味
たとえば、Cl- そしてF- それらはHと共有結合を形成しないが3○+, それらは他の分子間力、例えば水素架橋(それは- それらを受け入れることができます)。水素橋F--H-OH2+ Hの寄付を「妨げる」+.
フッ化水素酸(HF)がより弱い酸であるのはこのためです 水中で 臭化水素酸より。以来、イオン相互作用Br- H3○+ Hの転送を邪魔しないでください+.
しかし、水はHBr(ac)中に存在しますが、説明の最後のその振る舞いはH-Br分子のそれと似ています。つまり、H+ HBrまたはBrから転送されます-H3○+.
物理的および化学的性質
分子式
HBr.
分子量
80,972g / mol。前のセクションで説明したように、HBrのみが考慮され、水分子は考慮されないことに注意してください。分子量が式Brから得られる場合-H3○+ それはおよそ99 g / molの値を持つでしょう.
外観
無色または淡黄色の液体。溶解したHBrの濃度によって異なります。黄色になればなるほど、集中力が増して危険になります。.
匂い
刺激性、刺激性.
臭気閾値
6.67 mg / m3.
密度
1.49 g / cm3 (48%w / wの水溶液)。この値は、融点や沸点に対応するものと同様に、水に溶けているHBrの量に依存します。.
融点
-11ºC(12ºF、393ºK)(49%w / wの水溶液).
沸点
700mmHgで122℃(252°F、393°K)(水溶液47〜49%w / w).
水への溶解度
-221 g / 100 ml(0℃).
-204 g / 100 ml(15ºC).
-130 g / 100 ml(100ºC).
これらの値は、臭化水素酸ではなく、気体状のHBrを表しています。見てわかるように、温度を上げるとHBrの溶解度が下がる。ガスの中で自然なふるまい。その結果、高濃度のHBr(ac)溶液が必要な場合は、低温で使用することをお勧めします。.
高温で作業している場合、HBrは気体の二原子分子の形で脱出するため、漏れを防ぐために反応器を密閉する必要があります。.
蒸気密度
2.71(空気= 1に関して).
酸性度pKa
-9.0。このように負の定数は、その酸性度の高さを示しています.
カロリー容量
29.1 kJ / mol.
標準モルエンタルピー
198.7 kJ / mol(298ºK).
標準モルエントロピー
-36.3 kJ / mol.
発火点
不燃性.
命名法
その名前「臭化水素酸」は2つの事実を組み合わせたものです:水の存在、そして臭素は化合物中で-1の原子価を持ちます。英語ではもう少し明白です:臭化水素酸、ここで接頭辞「ヒドロ」(またはヒドロ)は水を表します。 、実際には、それはまた水素を指すことができます.
臭素は水素原子に結合しているので、それはそれより電気陰性度が低いので、-1の原子価を有する。しかし、それが酸素原子と結合または相互作用する場合、それは、+ 2、+ 3、+ 5および+7のような多数の原子価を有することができる。 Hは単一の原子価しか採用できないため、接尾辞-icoがその名前に追加されるのはそのためです。.
HBr(g)、臭化水素は、無水です。つまり、水がありません。それゆえ、それはハロゲン化水素のそれに対応する他の命名基準の下で命名される。.
それはどのように形成されていますか?
臭化水素酸を調製するためのいくつかの合成方法がある。それらのいくつかは以下のとおりです。
水中の水素と臭素の混合物
技術的詳細を説明することなく、この酸は水で満たされた反応器中で水素と臭素の直接混合物から得ることができる。.
H2 + Br2 => HBr
このようにして、HBrが形成されると、それは水に溶解する。これはそれを蒸留に引きずり込む可能性があるので、溶液は異なる濃度で抽出することができる。水素は気体、臭素は濃い赤みを帯びた液体.
三臭化リン
より手の込んだ方法では、砂、水和した赤リンおよび臭素が混合される。水トラップを氷浴中に入れて、HBrが逃げて臭化水素酸を形成するのを防ぐ。反応は次のとおりです。
2P + 3Br2 => 2PBr3
PBr3 + 3H2O => 3HBr + H3PO3
二酸化硫黄と臭素
それを調製するための別の方法は、水中で臭素を二酸化硫黄と反応させることである。
Br2 + そう2 + 2H2O => 2HBr + H2そう4
これは酸化還元反応です。 Br2 水素と結合することによって還元し、電子を得る。 SOの間2 硫酸のように他の酸素ともっと共有結合を形成すると、酸化して電子を失う.
用途
臭化物の製造
HBr(ac)を金属水酸化物と反応させると臭化物塩を製造することができる。例えば、臭化カルシウムの生産は考慮されます:
Ca(OH)2 + 2HBr => CaBr2 + H2○
別の例は臭化ナトリウムの場合です。
NaOH + HBr => NaBr + H2○
従って、多くの無機臭化物を製造することができる。.
ハロゲン化アルキルの合成
そして、有機臭化物についてはどうですか?これらは有機臭素化化合物です:RBrまたはArBr.
アルコールの脱水
それらを得るための原料はアルコールであり得る。 HBrの酸性度によりプロトン化されると、それらは水を形成し、これは良好な出て行く基であり、代わりにBrの嵩高い原子が取り込まれ、それは炭素と共有結合するようになる。
ROH + HBr => RBr + H2○
この脱水は、R − OH結合の破壊を促進するために100℃を超える温度で行われる。2+.
アルケンおよびアルキンへの付加
HBr分子はその水溶液からアルケンまたはアルキンの二重または三重結合に付加することができる。
R2C = CR2 + HBr => RHC-CRBr
RC≡CR+ HBr => RHC = CRBr
いくつかの生成物を得ることができるが、単純な条件下では、臭素が第二級、第三級または第四級炭素に結合しているところで生成物が最初に形成される(マルコフニコフ則)。.
これらのハロゲン化物は他の有機化合物の合成に干渉し、そしてそれらの用途の範囲は非常に広い。また、それらのいくつかは新薬の合成やデザインにも使用できます。.
エーテルの断絶
エーテルから、それぞれ初期エーテルR − O − R ’の2つの側鎖RまたはR’のうちの一方を有する2つのハロゲン化アルキルを同時に得ることができる。アルコールの脱水と似たようなことが起こりますが、その反応メカニズムは異なります.
反応は以下の化学式で図式化することができる。
ROR '+ 2HBr => RBr + R'Br
そして水も放出されます.
触媒
その酸性度は、それが有効な酸触媒として使用できるようなものである。 Brアニオンを添加する代わりに- 分子構造に対して、他の分子がそれを行う方法を開く.
参考文献
- Graham Solomons T.W.、Craig B. Fryhle。 (2011)。有機化学アミン(10番目 版。)。ワイリープラス.
- Carey F.(2008)。有機化学(第6版)。マックグローヒル.
- スティーブンA.ハーディンガー。 (2017)図解有機化学用語集:臭化水素酸。取得元:chem.ucla.edu
- ウィキペディア(2018)。臭化水素酸取得元:en.wikipedia.org
- PubChem。 (2018)。臭化水素酸取得元:pubchem.ncbi.nlm.nih.gov
- 労働安全衛生研究所。 (2011)。臭化水素[PDF]取得元:insht.es
- PrepChem。 (2016)臭化水素酸の製造以下から取得しました:prepchem.com


