分子幾何学タイプと例
の 分子幾何学 ○ 分子構造 中心原子の周りの原子の空間分布です。原子は、高い電子密度が存在する領域を表すため、形成されるリンクに関係なく(シングル、ダブル、またはトリプル)、電子グループと見なされます。.
この概念は、2つの理論の組み合わせと実験データから生まれました。それは、原子価結合(TEV)の理論と原子価殻の電子対の反発(VSPR)です。最初のものはリンクとそれらの角度を定義しますが、2番目のものはジオメトリを、そしてそれ故に、分子構造を確立します.

分子はどのような幾何学的形状を採用することができますか?前の2つの理論が答えを提供します。 VSEPRによれば、自由電子の原子および対は、それらの間の静電反発力を最小にするように空間内に配置されなければならない。.
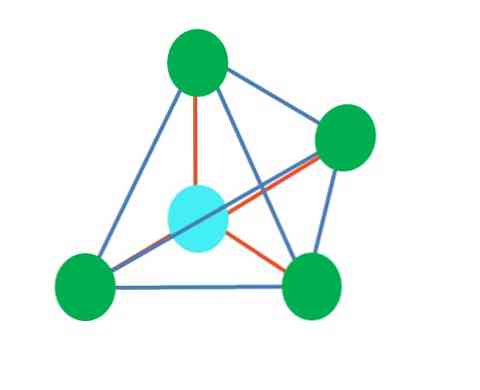
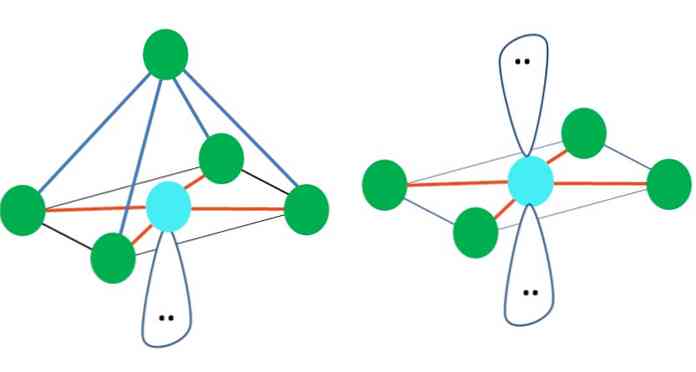
そのため、幾何学的形状は任意ではありませんが、最も安定したデザインを探してください。たとえば、上の画像では、左側に三角形が、右側に八面体が見えます。緑色の点は原子を表し、オレンジ色の縞はリンクを表しています.
三角形では、3つの緑色の点が120°の間隔で配置されています。結合の角度に等しいこの角度は、原子が互いにできるだけはじき合うことを可能にする。したがって、中心原子が他の3つに結合している分子は、三角面ジオメトリを採用します。.
しかしながら、VSCRは、中心原子内の自由電子対が幾何学を歪めると予測している。三角面の場合、このペアは3つの緑色の点を押し下げ、三角錐のジオメトリになります。.
画像の八面体についても同じことが起こり得ます。その中で、すべての原子は可能な限り最も安定した方法で分離されています.
索引
- 1原子の分子構造を事前に知る方法X?
- 2種類
- 2.1線形
- 2.2アングル
- 2.3四面体
- 2.4三角両錐
- 2.5八面体
- 2.6その他の分子形状
- 3例
- 3.1線形幾何学
- 3.2角ジオメトリ
- 3.3三角図
- 3.4四面体
- 3.5三角錐
- 3.6三角両錐
- 3.7振動
- 3.8 Tの形
- 3.9八面体
- 4参考文献
原子Xの分子幾何学を前もって知る方法?
そのためには、自由電子対も電子群とみなす必要がある。これらは、原子と一緒に、として知られているものを定義します 電子幾何学, これは分子幾何学の不可分の仲間です.
電子幾何学から、そしてルイス構造によって自由電子対を検出したことから、分子幾何学がどうなるかを確立することができる。すべての分子形状の合計は、グローバル構造の概要を示します。.
タイプ
主画像に見られるように、分子幾何学は中心原子を囲む原子の数に依存します。しかしながら、共有しないで一対の電子が存在する場合、それが多くの体積を占めるのでそれは幾何学を修正するであろう。したがって、それは立体効果を発揮します.
これによれば、幾何学は多くの分子に対して一連の特徴的な形状を提示することができる。そして、これは異なるタイプの分子幾何学または分子構造が生じるところです.
ジオメトリはいつ構造体と等しいのですか?構造体が複数のタイプのジオメトリを持たない場合にのみ、両方とも同じことを示します。それ以外の場合は、現在のすべての型を考慮し、構造にグローバル名(線形、分岐、球状、フラットなど)を指定する必要があります。.
形状は、その構造単位から固体の構造を説明するのに特に役立ちます。.
線形
全ての共有結合は方向性があるので、結合A − Bは線状である。しかし、AB分子は線状になりますか?2? そうであれば、形状は単純にB-A-Bのように表されます。 2つのB原子は180°の角度で分離されており、TEVによると、Aはsp混成軌道を持つ必要があります。.
角張った
それは最初の例ではAB分子のための線形幾何学と仮定することができます2;しかし、結論に達する前にルイスの構造を描くことが不可欠です。ルイスの構造を描くと、Aの原子を共有することなく電子対の数を識別することができます。.
そうであるとき、電子対の上にそれらはBの2つの原子を押し下げて、それらの角度を変える。結果として、線状分子B-A-BはV、ブーメラン、角の幾何学的形状になります(top image)
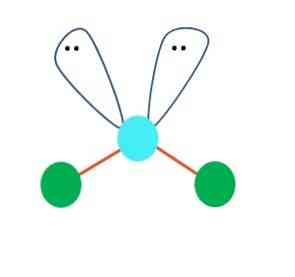
水分子H-O-Hは、このタイプのジオメトリの理想的な例です。酸素原子には、共有されていない2対の電子があり、それらはおよそ109°の角度で配向しています。.
なぜこの角度?電子幾何学は四面体なので、四つの頂点があります:二つはH原子用、二つは電子用。上の画像では、緑色の点と2つの「目の付いた葉」が青みがかった点を中心に四面体を描くことに注意してください。.
Oが自由電子対を持っていなければ、水は線状分子を形成し、その極性は減少し、そして海、海、湖などは、それらが知られているようにおそらく存在しないでしょう。.
四面体
上の画像は四面体形状を表しています。水分子の場合、その電子形状は四面体ですが、電子を含まない対を排除することによって角形状に変換されていることがわかります。これは、2つの緑色の点を削除することによっても観察されます。残りの2つは青い点でVを描画します.
もし2対の自由電子の代わりに1つしかないとしたら?それから三角平面(主画像)があるでしょう。しかしながら、電子基を除去することによって、一対の自由電子によって生じる立体効果は避けられない。したがって、それは三角平面を三角底ピラミッドに歪ませます。

三角錐と四面体ピラミッドの分子形状は異なりますが、電子形状は同じです。つまり四面体です。だから三角錐は電子幾何学としては数えない?
答えは「いいえ」です。なぜなら、それは「目を持つ葉」によって引き起こされる歪みとその立体効果の積であり、この幾何学は後の歪みを考慮に入れていないからです。.
このため、分子構造を定義する前に、まずLewis構造を使用して電子構造を決定することが常に重要です。アンモニア分子、NH3, 三角錐の分子形状の例ですが、四面体電子形状を持ちます。.
三角両錐
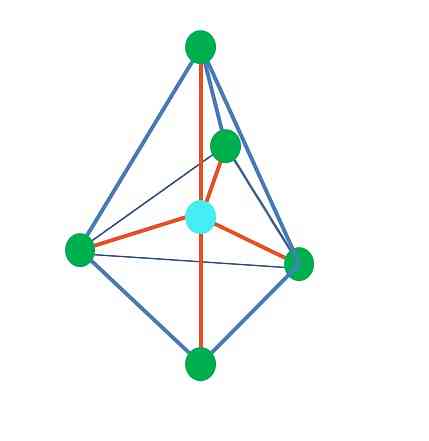
今までのところ、線形幾何学を除いて、四面体では、角錐と三角錐とその中心原子はsp混成を持っています3, TEVによると。これは、あなたのリンク角度が実験的に決定されたならば、それらはおよそ109ºであるべきであることを意味します.
三方両錐幾何から、中心原子の周りに5つの電子基があります。上の画像では、5つの緑色の点でわかります。三角の底辺に3つ、軸方向の位置に2つ(ピラミッドの上と下の頂点).
それでは、青い点はどのようなハイブリダイゼーションをしているのでしょうか。単純な結合を形成するには5つの混成軌道が必要です(オレンジ色)。これは5つのsp軌道によって達成されます。3d(軌道sと3つのpとa dの混合の積).
5つの電子グループを考慮すると、ジオメトリはすでに露光されていますが、共有せずに電子のペアを持っているので、これも歪みを受けて他のジオメトリを生成します。また、次の質問も起こります。これらのペアはピラミッド内の任意の位置を占めることができますか?これらは次のとおりです。軸方向または赤道方向.
軸方向および赤道位置
三角底を構成する緑色の点は赤道位置にあり、上端と下端の2つは軸方向位置にあります。共有されていない電子対はどこに配置されるのが好ましいでしょうか。静電反発力と立体効果を最小限に抑えるその位置に.
軸方向の位置では、電子対は三角形の底面に垂直に(90°)「押し」ますが、赤道位置にある場合は、底面の残りの2つの電子グループは120°離れ、両端を90°で押します。ベースと同じ3つ).
それゆえ、中心原子は赤道位置にその電子を含まない対を向けようとし、より安定した分子形状を生成する。.
振動とT字型
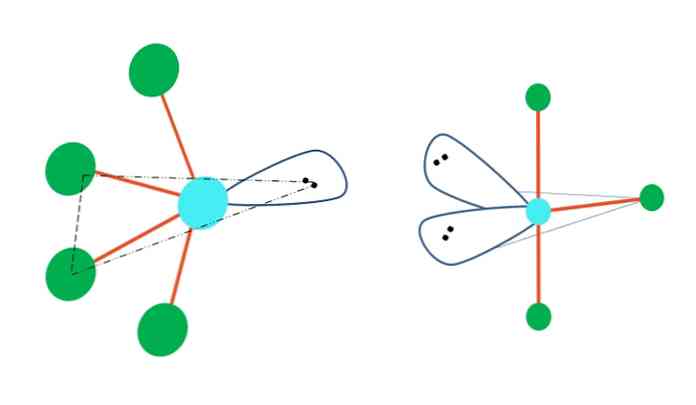
三方晶の二角錐幾何学がその原子の1つ以上を電子を含まない対で置き換えることであるならば、それはまた異なる分子幾何学を持つだろう.
一番上の画像の左側では、ジオメトリが振動するシェイプに変わります。その中で、自由電子対は残りの4つの原子を同じ方向に押し、それらのリンクを左に折りたたみます。このペアと2つの原子は、元のジピラミッドの同じ三角形の平面にあります。.
そして、画像の右側にあるT字型のジオメトリこの分子ジオメトリは、2対の電子を2つの原子で置き換えたもので、残りの3つの原子は同じ平面上に配置されています。 T.
つまり、AB型の分子の場合5, それは三角両錐幾何学を採用します。しかし、AB4, 同じ電子幾何学で、それは振動幾何学を採用するでしょう。とAB3, それらすべての中で、Aは(一般的に)sp混成を持つでしょう。3日.
分子幾何学を決定するためには、ルイス構造、ひいてはその電子幾何学を描くことが必要です。これが三方晶系二角錐の場合、電子を含まない対は破棄されますが、残りの原子に対する立体効果は除外されません。したがって、3つの可能な分子形状を完全に区別することが可能です。.
八面体
八面体分子ジオメトリは、メイン画像の右側に表示されます。このタイプの形状はAB化合物に対応します6. AB4 それらは正方形のベースを形成し、残りの2つのBは軸方向の位置に配置されます。したがって、八面体の面である正三角形がいくつか形成されます。.
ここでもまた、(すべての電子形状と同様に)自由電子対が存在する可能性があり、したがって、他の分子形状もこの事実から導き出される。例えば、AB5 八面体の電子ジオメトリでは、正方形のベースを持つピラミッドとABで構成されています。4 正方形の平面の
八面体電子幾何学の場合、これら2つの分子幾何学は静電反発力に関して最も安定している。正方形の平面形状では、2つの電子対は180°離れています.
これらの幾何学(またはそれが唯一のものであるならば構造)における原子Aの混成は何ですか?繰り返しますが、TEVはそれがspであることを証明します3日2, Aが八面体の頂点に電子群を向けることを可能にする6つの混成軌道.
その他の分子形状
これまでに述べたピラミッドの基部を修正することによって、いくつかのより複雑な分子形状を得ることができる。例えば、五角形のビピラミドは五角形に基づいており、それを形成する化合物は一般式ABを有する。7.
他の分子形状と同様に、電子を含まない対をB原子で置き換えると、形状が他の形に歪められます。.
また、AB化合物8 彼らはそのような正方形の反プリズムなどの形状を採用することができます。特にAB式では、一部の形状は非常に複雑になる可能性があります。7 それ以降(ABまで)12年).
例
次に、一連の化合物について、主な各分子形状について説明します。演習として、すべての例についてルイス構造を描き、電子ジオメトリが与えられた場合に、以下にリストされているような分子ジオメトリを得るかどうかを証明することができます。.
線形ジオメトリ
-エチレン、H2C≡CH2
-塩化ベリリウム、BeCl2 (Cl-Be-Cl)
-二酸化炭素、CO2 (O = C = O)
-窒素、N2 (N≡N)
-二臭化水銀、HgBr2 (Br-Hg-Br)
-三ヨウ化アニオン、私3- (私 - 私 - 私)
-シアン化水素、HCN(H-N≡C)
その角度は180°でなければならず、したがってsp混成を持っています.
角ジオメトリ
-水
-二酸化硫黄、SO2
-二酸化窒素、NO2
-オゾン、O3
-アニオンアミドロ、NH2-
三角面
-三フッ化ホウ素、BF3
-三塩化アルミニウム、AlCl3
-硝酸アニオン、NO3-
-炭酸アニオン、CO32-
四面体
-メタンガス、CH4
-四塩化炭素、CCl4
-カチオンアンモニウム、NH4+
-硫酸アニオン、SO42-
三角ピラミッド
-アンモニア、NH3
-陽イオンヒドロニウム、H3○+
三角両錐
-五フッ化リン、PF5
-五塩化アンチモン、SbF5
振動する
四フッ化硫黄、SF4
Tの形
-三塩化ヨウ素、ICl3
-三フッ化塩素、ClF3 (両方の化合物はハロゲン間化合物として知られています)
八面体
-六フッ化硫黄、SF6
-六フッ化セレン、SeF6
-ヘキサフルオロリン酸塩、PF6-
結局、分子幾何学は物質の化学的あるいは物理的性質の観察を説明するものです。ただし、これは電子ジオメトリに従って配置されているため、後者は常に最初のものより前に決定する必要があります。.
参考文献
- ホワイト、デイビス、ペック、スタンレー。化学(第8版)。 CENGAGEラーニング、p 194-198.
- シヴァー&アトキンス。 (2008)。無機化学(第4版、23〜24頁、80、169頁)。マックグローヒル.
- マークE.タッカーマン。 (2011)。分子幾何学とVSEPR理論以下から取得しました:nyu.edu
- 仮想Chembook、チャールズE. Ophardt。 (2003)。分子幾何学の紹介から取得しました:chemistry.elmhurst.edu
- 化学ライブラリテキスト。 (2016年9月8日)分子の幾何学取得元:chem.libretexts.org


