水酸化アンモニウムの構造、性質、命名法、用途
の 水酸化アンモニウム NH分子式の化合物です4OHまたはH5アンモニアガス(NH)の溶解では発生しない3)水中で。このため、それはアンモニア水または液体アンモニアの名前を受け取ります.
それは非常に強くて鋭い香りを持つ無色の液体です、そしてそれは絶縁性ではありません。これらの特性は、NH濃度と直接の関係があります。3 水に溶かした。実際にはガスであり、少量の水に溶け込んだ大量のガスをカバーできる濃度.
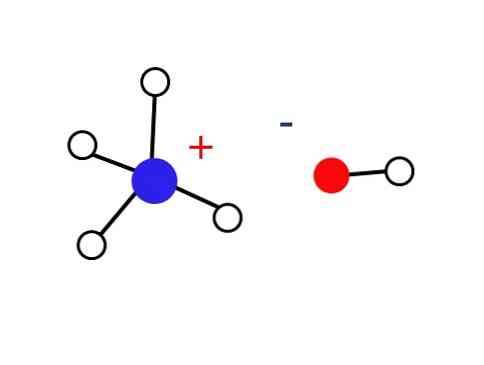
これらの水溶液のかなり小さい部分はNHカチオンからなる。4+ とOHアニオン-. 一方、非常に希薄な溶液や非常に低い温度の凍結した固体では、アンモニアは水和物の形で見られます。3∙H2O、2NH3∙H2OとNH3∙2H2○.
興味深いことに、木星の雲は水酸化アンモニウムの希薄溶液によって形成されています。しかし、ガリレオ宇宙探査機は惑星の雲の中に水を見つけることができなかった、それは水酸化アンモニウムの形成が知られているという知識から予想されるであろう。つまり、それらはNHクリスタルです。4OH完全無水.
アンモニウムイオン(NH4+)尿細管内腔では、尿細管細胞によって分泌されるアンモニアと水素の結合によって産生される。同様に、アンモニウムは、グルタミンのグルタミン酸への変換の過程において、そして次にグルタミン酸のα-ケトグルタル酸への変換の過程において、尿細管細胞において産生される。.
アンモニアは、窒素ガスと水素ガスを反応させるHaber-Bosch法によって工業的に製造されています。触媒として第二鉄イオン、酸化アルミニウムおよび酸化カリウムを使用する。反応は高圧(150〜300気圧)と高温(400〜500℃)で、10〜20%の収率で行われます。.
反応ではアンモニアが生成され、酸化されると亜硝酸塩と硝酸塩が生成されます。これらは硝酸や硝酸アンモニウムなどの肥料を得るのに不可欠です。.
索引
- 1化学構造
- 1.1アンモニア氷
- 2物理的および化学的性質
- 2.1分子式
- 2.2分子量
- 2.3外観
- 2.4集中
- 2.5匂い
- 2.6味
- 2.7しきい値
- 2.8沸点
- 2.9溶解度
- 2.10水への溶解度
- 2.11密度
- 2.12蒸気密度
- 2.13蒸気圧
- 2.14腐食作用
- 2.15 pH
- 2.16解離定数
- 3命名法
- 4溶解度
- 5つのリスク
- 5.1反応性
- 6つの用途
- 6.1食べ物に
- 6.2治療学
- 6.3工業用およびその他
- 6.4農業では
- 7参考文献
化学構造
その定義によって示されるように、水酸化アンモニウムはアンモニアガスの水溶液からなる。それゆえ、液体内には、NHイオンのランダム配置以外の明確な構造はない。4+ そしてOH- 水分子によって溶媒和される.
アンモニウムイオンとヒドロキシルイオンは、アンモニアの加水分解平衡の産物であるため、これらの溶液が刺激臭を持つのは一般的です。
NH3(g)+ H2O(l) <=> NH4+(ac)+ OH-(ac)
化学式によると、水分濃度が大幅に減少すると、平衡はより多くのアンモニアの形成にシフトします。すなわち、水酸化アンモニウムが加熱されると、アンモニア蒸気が放出されます。.
このため、NHイオン4+ そしてOH- 彼らはどうしても地上条件で結晶を形成することはできません4OHが存在しません.
この固体は静電的に相互作用するイオンのみで構成されている必要があります(図に示すように)。.
アンモニア氷
しかし、氷点下の気温の下で、氷のような月の核内に広がっているような巨大な圧力に囲まれ、アンモニアと水が凍結する。そうすることで、それらは様々な化学量論的比率を有する固体混合物に結晶化し、最も単純なNHである。3∙H2O:アンモニア一水和物.
NH3∙H2OとNH3∙2H2あるいは固体は水分子とアンモニアが水素結合で結合した結晶配列からなるので、それらはアンモニア性氷です。.
TとPの変化を考えると、これらの氷に対するすべての物理的変数とそれらの影響をシミュレートする計算研究によれば、NH相の遷移が起こる。3∙nH2あるいはNH相へ4OH.
したがって、これらの極端な条件でのみ、NH4OHはNH間の氷の中のプロトン化の生成物として存在するかもしれない3 そしてH2O:
NH3+ H2O(s) <=> NH4OH
今回は、アンモニアの加水分解とは異なり、関与する化学種は固相にあることに注意してください。アンモニアを放出せずに塩味になるアンモニア性氷.
物理的および化学的性質
分子式
NH4OHまたはH5いいえ
分子量
35,046 g / mol
外観
無色の液体です.
集中力
最大約30%(NHイオン用)4+ そしてOH-).
匂い
非常に強く鋭い.
味
エーカー.
しきい値
非特異的検出で34 ppm.
沸点
38℃(25%).
溶解度
水溶液中にのみ存在.
水への溶解度
無制限の割合で混ざり合う.
密度
0.90 g / cm3 25℃で.
蒸気密度
単位として取られる空気に関連して:0.6。つまり、空気よりも密度が低くなります。しかしながら、論理的に報告された値は気体としてのアンモニアを指し、その水溶液またはNH 2を指すのではない。4OH.
蒸気圧
25℃で2.160 mmHg.
腐食作用
それは亜鉛および銅を分解することができます.
pH
11.6(溶液1N)。 11.1(溶液0.1 N)および10.6(0.01N溶液).
解離定数
pKb = 4,767。 Kb = 1.71×10-5 20℃で
pKb = 4.751。 Kb = 1,774×10-5 25℃で.
温度の上昇は水酸化アンモニウムの塩基度をほとんど知覚できないほど上昇させる.
命名法
NHが受ける一般的な正式名は何ですか?4OH?それがヒドロキシルアニオンを含んでいるのでIUPACによって確立されたものによると、その名前は水酸化アンモニウムです.
その負荷+1によるアンモニウムは一価であり、なぜ命名ストックを使用するのかという理由:水酸化アンモニウム(I).
水酸化アンモニウムという用語の使用は技術的には間違っていますが、化合物は単離できないため(少なくとも最初のセクションで詳しく説明したように地球上にはありません).
さらに、水酸化アンモニウムはアンモニア水および液体アンモニアの名前を受け取ります.
溶解度
NH4OH、地上条件では塩がないので、それがさまざまな溶媒にどれだけ溶けやすいかを推定することはできません。.
しかし、それが溶解すると大量のNHが放出されるので、それは非常に水溶性であると予想するであろう。3. 理論的には、それはアンモニアを貯蔵し輸送するための素晴らしい方法です。.
アルコールおよびアミンのような水素結合を受容することができる他の溶媒においては、それがそれらに非常に可溶性であることも予想され得る。ここでNH陽イオン4+ 水素架橋の供与体であり、そしてOHは- それは両方のように動作します.
メタノールとのこれらの相互作用の例は、3N+-H - OHCH3 とHO- - HOCH3 (OHCH3 メチル基がHに結合しているのではなく、酸素が水素結合を受けていることを示す.
リスク
-眼と接触すると刺激を引き起こし、眼に損傷を与えることがある.
-腐食性です。したがって、皮膚に触れると刺激を引き起こす可能性があり、高濃度の試薬では皮膚のやけどを引き起こす可能性があります。水酸化アンモニウムと皮膚の接触を繰り返すと、乾燥、かゆみ、発赤(皮膚炎)を引き起こすことがあります。.
-水酸化アンモニウムスプレーの吸入は、窒息、咳または息切れを特徴とする気道の急性刺激を引き起こす可能性があります。長期にわたる、または繰り返しの物質への暴露により、再発性気管支感染症が起こることがあります。また、水酸化アンモニウムの吸入は肺の炎症を引き起こす可能性があります.
-高濃度の水酸化アンモニウムにさらされると、肺内に水分がたまる(肺水腫)ことがあるため、医療上の緊急事態になる可能性があります。.
-労働者が水酸化アンモニウムの有害な作用にさらされる環境で、8時間の勤務シフトで、25ppmの濃度がばく露限度として採用されている.
反応性
-さらに、水酸化アンモニウムへの暴露による健康被害の可能性があるため、この物質を取り扱う際に考慮しなければならないその他の注意事項があります。.
-水酸化アンモニウムは、銀、銅、鉛、亜鉛などの多くの金属と反応する可能性があります。それはまたこれらの金属の塩と反応して爆発性化合物を形成しそして水素ガスを放出する。これは引火性で爆発性です.
-例えば塩酸、硫酸、硝酸などの強酸と激しく反応することがあります。同様に、それは硫酸ジメチルおよびハロゲンと同じように反応する.
-水酸化ナトリウムや水酸化カリウムなどの強塩基と反応し、気体アンモニアを生成する。これは、溶液中の平衡が観察されるかどうかを確認することができます。- バランスをNH生成にシフト3.
-水酸化アンモニウムを取り扱うとき、それらの腐食作用のために、銅およびアルミニウム金属、ならびに他の亜鉛メッキ金属は使用されるべきではありません。.
用途
食べ物に
-それは食品表面の膨張剤、pH調整剤および仕上げ剤として作用する多くの食品の添加剤として使用されています。.
-水酸化アンモニウムが使用されている食品のリストは広範で、焼き菓子、チーズ、チョコレート、キャンディー、プリンなどがあります。.
-水酸化アンモニウムは、確立された基準に従うことを条件として、食品加工用のFDAによって安全な物質として分類されています。.
-食肉製品では、抗菌剤として使用され、大腸菌などのバクテリアを排除し、検出不可能なレベルまで減らします。バクテリアは牛の腸内にあり、酸性環境に適応しています。水酸化アンモニウムは、pHを調整することにより、バクテリアの成長を妨げます。.
治療学
-水酸化アンモニウムには、次のようないくつかの治療用途があります。
-10%の解決は呼吸反射の興奮剤として使用されます
-外的にそれは昆虫の咬傷や咬傷の治療のために皮膚に使用されています - それは制酸剤や駆虫剤として消化器系に作用します。.
さらに、それは急性および慢性の筋骨格痛のための局所的な潤滑剤として使用されています。水酸化アンモニウムの滑らかな作用の結果として、血流、発赤および刺激の局所的な増加があります.
工業用およびその他
-それは、NOx(一酸化窒素(NO)および二酸化窒素(NO)のような高反応性ガスの低減に作用する)2)煙突排出物中のスタック排出物およびNOx低減のため).
-可塑剤として使用されます。塗料用添加剤および表面処理用.
-それは髪の気孔率を増加させて、染みの顔料がより大きな浸透を持つことを可能にします。そして、それはより良い仕上げを達成します.
-水酸化アンモニウムは、廃水処理における抗菌剤として使用されています。さらに、それはクロラミンの合成に介入します。この物質は、プールの水の浄化において塩素と同様の機能を果たし、毒性が低いという利点があります。.
-それは石油精製プロセスの腐食防止剤として使用されています.
-ステンレス鋼、磁器、ガラスおよびオーブンを含むいくつかの表面で使用されています。.
-さらに、それは洗剤、石鹸、医薬品およびインクの製造に使用されています.
農業では
水酸化アンモニウムは、肥料として直接投与されるわけではありませんが、この機能を果たします。アンモニアは、大気中の窒素からHaber-Bosch法で製造され、その沸点(-33℃)以下で冷蔵されて使用場所に運ばれます。.
加圧されたアンモニアは蒸気の形で土の中に注入され、そこでそれは直ちに水道水と反応しそしてアンモニウムの形(NH4+)、土壌陽イオン交換サイトに保持されています。さらに、水酸化アンモニウムが生成される。これらの化合物は窒素源です.
窒素は、リンやカリウムと一緒になって、その成長に不可欠な植物の主要栄養素の3つ一組を構成します。.
参考文献
- Ganong、W. F.(2002)。Medical Physiology。第19版。編集モダンマニュアル.
- A.D.Fortes、J.P.Brodholt、I.G.Wood、およびL.Vocadlo。 (2001)。アンモニア一水和物(NH)のab initioシミュレーション3∙H2O)と水酸化アンモニウム(NH)4OH)。アメリカ物理学研究所。 J. Chem。Phys。、第115巻、第15、15.
- Helmenstine、Anne Marie、Ph.D. (2017年2月6日)水酸化アンモニウムの事実以下から取得しました:thoughtco.com
- ポヒテカグループ。 (2015)水酸化アンモニウムpochteca.com.mx
- NJ Health (S.F.)。有害物質に関するファクトシート:水酸化アンモニウム。 [PDF]取得元:nj.gov
- 化学学習者。 (2018)。水酸化アンモニウムから取得した場所:chemistrylearner.com
- PubChem。 (2018)。水酸化アンモニウム取得元:pubchem.ncbi.nlm.nih.gov


