原子半径測定方法、周期表の変化の仕方、例
の 原子半径 周期表の元素の周期的性質にとって重要なパラメータです。より大きい半径では、より大きいまたはかさばるので、それは原子のサイズに直接関係します。同様に、それは同じの電子特性に関連しています.
原子がより多くの電子を持っている限り、そのサイズと原子半径は大きくなります。両方とも原子価殻の電子によって定義されます。なぜなら、それらの軌道を超える距離では、電子を見つける確率はゼロに近づくからです。核の近くでは反対のことが起こります。電子を見つける確率が高まります.

上の画像は綿球のパッキングを表しています。他の可能な上または下の行を数えることなく、それぞれが6つの隣人によって囲まれていることに注意してください。綿球がどのように圧縮されるかによって、それらのサイズ、したがってそれらの半径が決まります。原子と同じように.
元素は、その化学的性質に応じて、何らかの形で独自の原子と相互作用します。したがって、原子半径の大きさは、存在する結合の種類とその原子の固体パッキングによって異なります。.
索引
- 1原子半径はどのように測定されますか?
- 1.1核間距離の決定
- 1.2台
- 2周期表の変化は??
- 2.1ある期間にわたって
- 2.2グループで降順に
- 2.3ランタニド収縮
- 3例
- 4参考文献
原子半径はどのように測定されますか?
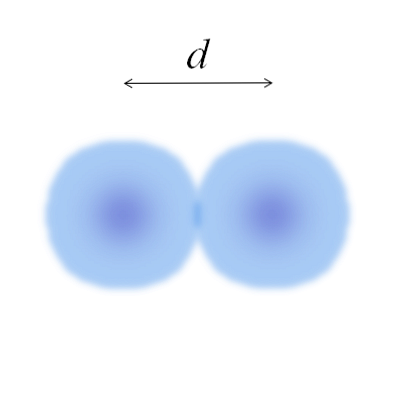
メイン画像では、コットンボールの直径を測定し、次にそれを2で割るのは簡単です。しかし、原子の球は完全に定義されていません。なんで?なぜなら、電子は空間の特定の領域を循環し拡散するからです。.
それゆえ、原子は、計り知れないほどのエッジを持つ球と見なすことができます。たとえば、上の画像では、核の近くにある中央領域がより濃い色に見えますが、エッジはぼやけています.
この画像は二原子分子Eを表します。2 (Clとして2, H2, ○2, など)。原子が球体であると仮定して、距離が決まれば 日 それは共有結合で両方の核を分離する、それでそれを2つの半分に分けることで十分だろう(日/ 2)原子半径を求める。より正確には、Eに対するEの共有半径2.
そして、もしEがそれ自身と共有結合を形成しないならば、それは金属元素ですか?それから 日 それは金属構造の中でEを取り巻く隣人の数によって示されるでしょう。つまり、包装内の原子の配位数(N.C)によるものです(メイン画像の綿球を思い出してください)。.
核間距離の決定
決定する 日, これは、分子またはパッケージング中の2つの原子の核間距離です。物理分析技術が必要です。.
最も一般的に使用されているものの1つはX線回折であり、その中で光ビームは結晶を通して照射され、そして電子と電磁放射線との間の相互作用から生じる回折パターンが研究されている。充填に応じて、異なる回折パターンが得られ、それ故、他の値の 日.
原子が結晶格子内で「タイト」である場合、それらはの異なる値を示します。 日 彼らが「快適」であるなら彼らが持っているであろうものと比較して。また、これらの核間距離は値で振動する可能性があるため、原子半径は実際にはそのような測定値の平均値で構成されます。.
原子半径と配位数はどのように関連していますか? V. Goldschmidtは両者の間の関係を確立した。そこでは12のN.Cに対して相対値は1である。原子のN.Cが8の場合、パッキングの0.97から。 6に等しいN.C.については0.96である。 NCが4の場合は0.88.
単位
12に等しいN.Cの値から、周期表のすべての元素の原子半径を比較して多くの表が作成されました。.
すべての元素がそのようなコンパクトな構造(12未満のN.C)を形成するわけではないので、V. Goldschmidtの関係は、それらの原子半径を計算し、それらを同じ充填のために表現するために使用されます。このように、原子半径の測定は標準化されています.
しかし、彼らはどのような単位で彼ら自身を表現しますか?から 日 大きさは非常に小さく、オングストローム単位Å(10∙10)に頼るべきです-10年m)または広く使われている、ピコメーター(10∙10-12年m).
周期表における変化?
期間を通して
金属元素について決定された原子半径は金属半径と名付けられているが、それらの非金属元素については共有半径(リン、リンなど)4, または硫黄、S8)ただし、両方のタイプの無線機の間には、名前よりも顕著な違いがあります。.
同じ期間の左から右に、核は陽子と電子を追加しますが、後者は同じエネルギー準位(主量子数)に制限されます。結果として、原子核は原子価電子に増加する実効核電荷を及ぼし、それが原子半径を縮小する。.
このように、同時期の非金属元素は、金属(金属半径)よりも原子(共有)半径が小さい傾向があります。.
グループで降順
グループによって下降するとき、新しいレベルのエネルギーが可能になり、それは電子がより多くの空間を持つことを可能にする。このように、電子雲はより長い距離をカバーし、そのぼやけた周縁は核からより遠くに移動することになり、それ故に、原子半径は拡大する.
ランタニド収縮
内層の電子は、価電子上の有効核電荷を遮蔽するのを助ける。 f軌道のように、内層を構成する軌道に多数の「穴」(節点)がある場合、軌道の遮蔽効果が弱いために原子核は原子半径を強く収縮します。.
この事実は、周期表の期間6のランタニド収縮で証明されています。 LaからHfまでは、軌道fによって生成される原子半径のかなりの縮小があります。それは、ブロックfを通過するときに「満たされます」:ランタノイドとアクチノイドのそれ.
同様の効果が、期間4からのブロックpの元素についても観察され得る。今回は、遷移金属の期間を横切るときに満たされる軌道dの弱い遮蔽効果の積である。.
例
周期表の周期2の場合、その元素の原子半径は次のとおりです。
-李:257午後
-:112 pm
-B:88時
-子:77時
-N:74午後
-O:66時
-F:64 p.m.
リチウム金属は最大の原子半径(257μm)を有し、一方、周期の最も右側に位置するフッ素はそれらのうち最小(64μm)であることに留意されたい。原子半径は同じ周期で左から右へと下降し、リストされた値はそれを示しています.
リチウム、金属結合を形成することによって、その半径は金属です。フッ素は、それが共有結合(F − F)を形成するので、その半径は共有結合である。.
そして、もしあなたが原子ラジオをオングストロームの単位で表現したいとしたら?単純にそれらを100で割る:(257/100)=2.57Å。その他の値についても同様です。.
参考文献
- ケミストリー301.原子半径。取得元:ch301.cm.utexas.edu
- CK-12財団。 (2016年6月28日)原子半径取得元:chem.libretexts.org
- 原子半径の傾向撮影元:intro.chem.okstate.edu
- クラカマスコミュニティカレッジ。 (2002)。原子サイズ取得元:dl.clackamas.edu
- Clark J.(2012年8月)原子半径とイオン半径取得元:chemguide.co.uk
- シヴァー&アトキンス。 (2008)。無機化学(第4版、23〜24頁、80、169頁)。マックグローヒル.


