硫化ナトリウム処方、用途、リスク
の 硫化ナトリウム (Na 2 S)は黄色から赤レンガ色までの結晶性固体である。自然界ではさまざまな水和度で見られ、最も一般的な硫化ナトリウム9水和物(Na 2 S・9H 2 O)です。.
それらは強アルカリ性溶液を与える水溶性塩である。湿った空気にさらされると、それらは空気から湿気を吸収します。同様に、湿った空気と接触すると、それらは硫化水素を放出します。.

それらは強力な還元剤です。これらの物質は環境、特に水生生物に危険を及ぼす可能性があります。.
一硫化ナトリウムは、60〜62%のNaを含有するフレークの形態で市販されている。2S ...
- 式

- CAS:1313-82-2硫化ナトリウム(無水)
- CAS:1313-84-4硫化ナトリウム(非水和)
二次元構造
3D構造
硫化ナトリウムの特性
物理的および化学的性質

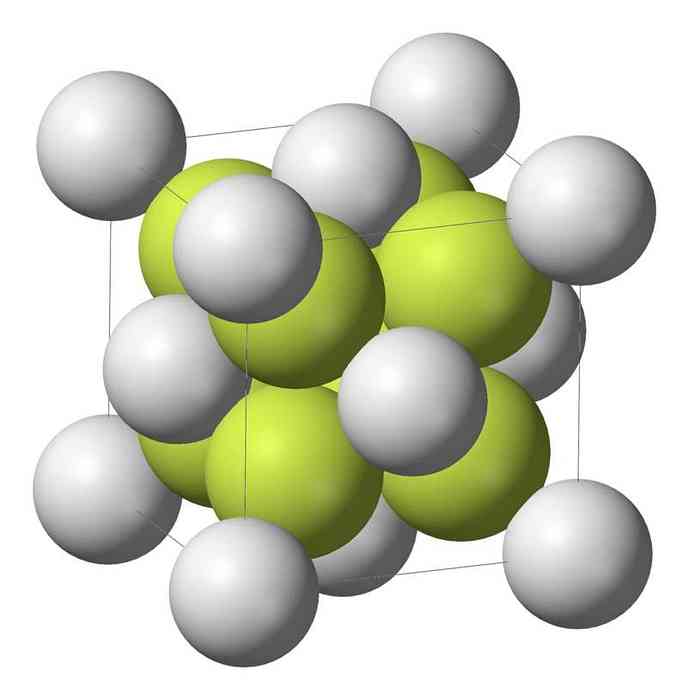
一硫化ナトリウム(Na 2 S)はアンチフルオライト構造で結晶化し、ここで各S原子は8個のNa原子の立方体によって、そして各Na原子は4個のS原子の四面体によって囲まれる。.
可燃性
無機硫化物のグループの唯一の非常に可燃性のメンバーは硫化水素です。ただし、硫化ナトリウムなどの他の無機硫化物は、湿気にさらされると自然に発熱し、さらには発火する可能性があります。.
火にさらされると、硫化ナトリウムは刺激性または有毒な二酸化硫黄のガスまたは蒸気を放出します.
反応性
- 無機硫化物は一般的に塩基性です(強塩基性であるため、酸と相溶性がないものもあります)。.
- これらの化合物の多くは還元剤です(酸化剤と激しく反応します)。.
- 硫化物の単純な塩(硫化ナトリウム、硫化カリウム、硫化アンモニウムなど)は酸と激しく反応し、非常に有毒で可燃性の硫化水素ガスを放出します。.
- 硫化ナトリウムは可燃性です。急速に加熱されるか、または当たると爆発する可能性がある.
- 分解するまで加熱すると、酸化ナトリウムおよび硫黄酸化物の有毒な蒸気を放出する.
- 炭、ジアゾニウム塩、N、N-ジクロロメチルアミン、強酸化剤、および水と、炭素と激しく反応する。.
毒性
無機硫化物のグループの多くのメンバーは強塩基として振る舞います、そして彼らが皮膚と接触すると、重度の火傷を引き起こすことがあります.
この性質はその溶解度に依存する。最も不溶性の無機硫化物(例えば、硫化水銀(II)や硫化カドミウム)は苛性アルカリではありません。.
硫化ナトリウムは、オクタノール/水分配係数(Pow)媒体(-3.5)を有する。この値は、動物性脂肪組織(特に水生動物)中の物質の溶解度(および生物濃縮度)の尺度として使用されます。.
硫化ナトリウムは環境、特に水生生物にとって危険であると考えられています.
用途
家庭では、硫化ナトリウムは露出しているパイプ、家庭用洗剤(炉、浴室用)、ストレートヘアアイロン、食器用洗剤およびオートエアバッグに使用されています。.
工業では、それは洗剤で、セメントで、そして他の化学製品の生産の前駆体として使われます.
臨床効果
硫化ナトリウムへのばく露は、産業界でも家庭でも先進国と低開発国で一般的である。これらの腐食性物質は、低濃度でいくつかの家庭用製品に含まれています.
先進国では、深刻な影響はまれです。これらは主に成人の化学物質の意図的な摂取によるものです。しかし、途上国では、深刻な影響がより一般的です.
アルカリ性腐食剤は液化による壊死を引き起こします。細胞膜の脂肪を鹸化して細胞を破壊し、粘膜の組織に深く浸透させる.
経口ばく露
最初の炎症は消化管組織に起こり、続いて組織壊死(穿孔の可能性あり)、それから肉芽形成、そして最後に狭窄形成が起こります.
軽度の摂取をした患者は、口腔咽頭、食道または胃の炎症またはグレードIの火傷(表在性充血および浮腫)を発症する.
中等度の中毒を持つ患者は、さらに狭窄症(特に食道)が形成される可能性があるグレードIIの火傷(表在性水疱、びらん、潰瘍)を発症することがあります。.
一部の患者(特に幼児)は上気道に浮腫を発症する可能性がある.
経口摂取による重度の中毒を持つ患者は、以下のような合併症を伴う、重度の火傷および消化管粘膜の壊死を発症する可能性があります。.
それらは発症する可能性があります:低血圧、頻脈、頻呼吸、狭窄形成(主に食道)、食道癌および上気道の浮腫(これは一般的で命にかかわることが多いです).
重度の中毒は一般に成人の意図的な摂取に限られています.
吸入によるばく露
軽度のばく露は咳や気管支痙攣を引き起こす可能性がある.
激しい吸入は上気道浮腫、火傷、喘鳴、そしてまれに急性肺損傷を引き起こす可能性があります。.
目の露出
それは重度の結膜刺激およびケモーシス、角膜上皮欠陥、辺縁系虚血、永久的な視力喪失および重度の穿孔の場合を生じ得る。.
経皮ばく露
穏やかな暴露は刺激および部分的なやけどを引き起こす。代謝性アシドーシスは重度の火傷またはショックを受けた患者に発症する可能性があります.
長期の暴露または高濃度の製品は全層熱傷を引き起こす可能性が.
セキュリティとリスク
化学物質の分類と表示のための世界的に調和したシステム(SGA)の危険ステートメント
化学物質の分類と表示のための世界的に統一されたシステム(SGA)は、国際的に合意されたシステムで、国連によって作成され、世界中の一貫した基準を使用することによって異なる国で使われるさまざまな分類と表示標準を置き換えるように設計.
危険有害性クラス(およびGHSの対応する章)、分類および表示基準、および硫化ナトリウムに関する推奨事項は次のとおりです(European Chemicals Agency、2017、国連、2015、PubChem、2017)。







参考文献
- Benjah-bmm27、(2006)。蛍石ユニットセル3Dイオン[画像]投稿者:wikipedia.org.
- ChemIDplus、(2017)。 1313-82-2 [画像]取得元:chem.nlm.nih.gov.
- ChemIDplus、(2017)。 1313-82-2 - 硫化ナトリウムの三次元構造[画像]投稿者:chem.nlm.nih.gov.
- ChemIDplus、(2017)。 1313-84-4 - 硫化ナトリウムの3次元構造[画像]投稿者:chem.nlm.nih.gov.
- 欧州化学品庁(ECHA)。 (2017)分類とラベリングのまとめ.
- 調和のとれた分類 - 規則附属書VI(EC)No 1272/2008(CLP規則)。硫化ナトリウム2017年1月16日、echa.europa.euから取得.
- 欧州化学品庁(ECHA)。 (2017)分類とラベリングのまとめ.
- 通知された分類と表示硫化ナトリウム、水和。 2017年1月16日、echa.europa.euから取得.
- 有害物質データバンク(HSDB)。 TOXNET (2017)硫化ナトリウムベセスダ、MD、EU:国立医学図書館。取得元:toxnet.nlm.nih.gov.
- Lange、L.、&Triebel、W.(2000)。硫化物、ポリスルフィド、およびスルファン。ウルマンの産業化学百科事典で。 Wiley-VCH Verlag GmbH&Co. KGaA。 dx.doi.orgから取得.
- 国連(2015)化学製品の分類と表示のための世界的に調和したシステム(SGA)第6改訂版。ニューヨーク、アメリカ合衆国:国連出版物。取得元:unece.org.
- 国立バイオテクノロジー情報センターPubChem化合物データベース。 (2016)硫化ナトリウムエン水和物 - PubChem構造[画像]取得元:pubchem.ncbi.nlm.nih.gov.
- 国立バイオテクノロジー情報センターPubChem化合物データベース。 (2017)一硫化ナトリウム。ベセスダ、MD、EU:国立医学図書館。取得元:pubchem.ncbi.nlm.nih.gov.
- 国立バイオテクノロジー情報センターPubChem化合物データベース。 (2017)硫化ナトリウムエナ水和物。ベセスダ、MD、EU:国立医学図書館。取得元:pubchem.ncbi.nlm.nih.gov.
- 国立海洋大気庁(NOAA)。 CAMEOケミカルズ(2017)化学データシート硫化ナトリウム、無水。シルバースプリング、メリーランド州。 EU;以下から取得しました:cameochemicals.noaa.gov.
- 国立海洋大気庁(NOAA)。 CAMEOケミカルズ(2017)反応性グループデータシート。硫化物、無機。シルバースプリング、メリーランド州。 EU;以下から取得しました:cameochemicals.noaa.gov.
- OndřejMangl、(2007)。硫化ナトリウム - Na 2 S [画像]から取得した場所:wikipedia.org.
- PubChem、(2016)。一硫化ナトリウム[画像]取得元:puchem.nlm.nih.gov.
- PubChem、(2016)。硫化ナトリウムエナ水和物[画像]取得元:puchem.nlm.nih.gov.
- ウィキペディア(2017)オクタノール - 水分配係数2017年1月17日、wikipedia.orgから取得しました.
- ウィキペディア(2017)硫化ナトリウム2017年1月17日、wikipedia.orgから取得しました.


