炭素原子の特性、構造、ハイブリダイゼーション、分類
の 炭素原子 それはおそらくそれのおかげで生命の存在が可能であるので、それはおそらくすべての要素の中で最も重要で象徴的です。それはそれ自身で、少数の電子、あるいは陽子と中性子を持つ核だけでなく星の塵も取り囲みます。.
また、地球の地殻には炭素原子が含まれていますが、鉄、炭酸塩、二酸化炭素、石油、ダイヤモンド、炭水化物などの金属元素に匹敵する量はありません。その物理的および化学的症状.
しかし、炭素原子はどうですか?最初の不正確なスケッチは上の画像で観察されたもので、その特徴は次のセクションで説明されています.
炭素原子は大気、海、下層土、植物そしてあらゆる動物種を通って移動します。その大きな化学的多様性は、リンクの安定性が高いことと、それらが宇宙でどのように順序付けられているかによるものです。したがって、それは一方では滑らかで潤滑性のグラファイトを有する。そして、その硬度は多くの材料の硬度を上回るダイヤモンド.
炭素原子がそれを特徴付ける性質を持っていなければ、有機化学は完全には存在しないでしょう。その同素体構造(カーボンナノチューブ、グラフェン、フラーレンなど)の設計と機能化を通して、将来の新しい材料を見ている先見の明のある人たちもいます。.
索引
- 1炭素原子の特徴
- 2つの構造
- 3ハイブリダイゼーション
- 3.1 sp3
- 3.2 sp2とsp
- 4分類
- 4.1一次
- 4.2二次
- 4.3三次
- 4.4第四紀
- 5つの用途
- 5.1原子質量単位
- 5.2炭素循環と寿命
- 5.3 13 C NMR分光法
- 6参考文献
炭素原子の特徴
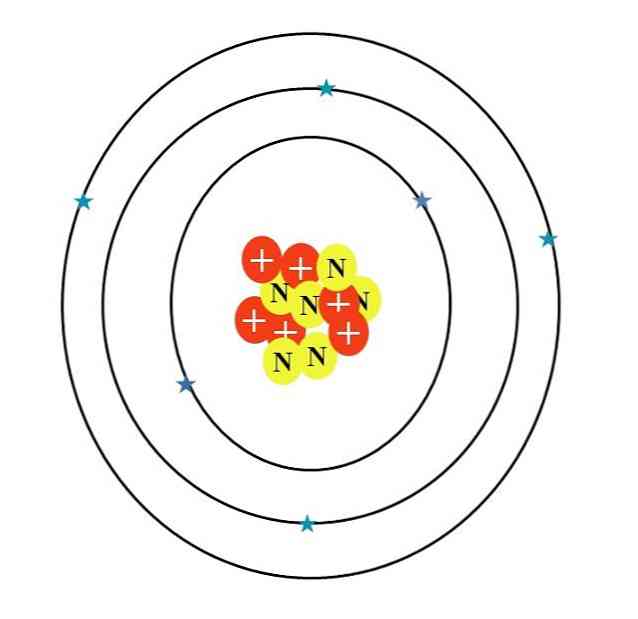
炭素原子は文字Cで記号化されています。その原子番号Zは6であるため、6つのプロトンがあります(核内に記号「+」の付いた赤い丸)。さらに、それは6つの中性子(文字「N」の付いた黄色い丸)と最後に6つの電子(青い星)を持っています.
それらの原子粒子の質量の合計は12.0107 uの平均値を与える。ただし、画像内の原子は12炭素同位体に対応します(12年C)dからなる。のような他の同位体 13年Cと 14年豊富ではないCは、中性子の数のみが異なります.
だから、あなたがこれらの同位体を描くならば 13年Cには追加の黄色い丸が付きます。 14年C、あと2人。これは論理的には重い炭素原子であることを意味します.
これに加えて、これに関して他にどんな特徴が言及されることができますか?それは四価であり、すなわちそれは4つの共有結合を形成することができる。周期律表の14族(VAT)、より具体的にはブロックpにあります。.
それはまた、周期律表のほとんどすべての元素と結びつけることができる非常に用途の広い原子です。特にそれ自体で、高分子および直鎖、分岐鎖およびラメラポリマーを形成する.
構造
炭素原子の構造は何ですか?この質問に答えるには、まずあなたはあなたの電子構成に行かなければなりません:1s22秒22p2 または[彼] 2秒22p2.
したがって、軌道は3つあります。2, 2秒2 そして2p2, それぞれ2つの電子を持つ。これは上の画像でも見ることができます:それぞれ2つの電子(青い星)を持つ3つの環(軌道によって環を混同しないでください:それらは軌道です).
ただし、2つの星は他の4つの星よりも濃い青になります。なんで?最初の2つは内層1sに対応するため2 化学結合の形成に直接関与していない。外層の電子2sと2pは.
s軌道とp軌道は同じ形をしていないので、図の原子は現実のものとは異なります。電子と核の間の距離の大きな不均衡に加えて、それは何百倍も大きいはずです.
したがって、炭素原子の構造は、電子が拡散した電子雲に「溶け込む」3つの軌道から成ります。そして、原子核とこれらの電子の間には、私たちが原子の中の計り知れない「空」を垣間見ることを可能にする距離があります.
ハイブリダイゼーション
炭素原子は四価であることは前述した。その電子配置によると、その2s電子は対になり、2p電子は不対になります。
空いていて窒素原子の中にある追加の電子で満たされた利用可能なp軌道が残っている(2p3).
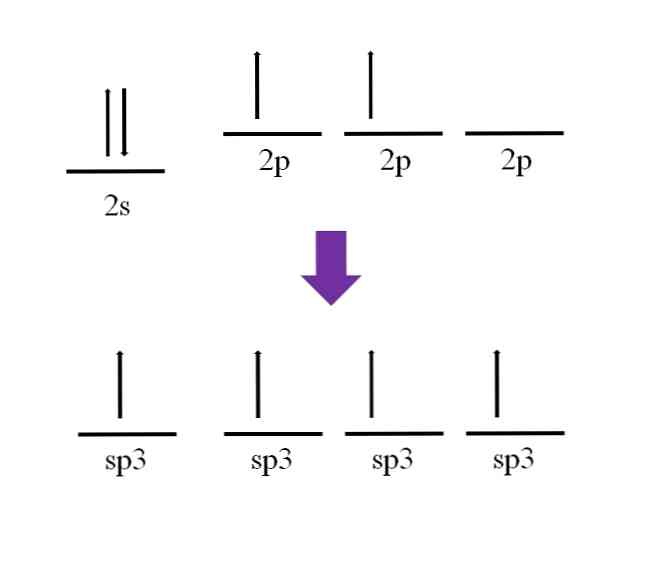
共有結合の定義によると、各原子はその形成のために電子に寄与することが必要である。しかし、 基底状態 炭素原子のうち、それは2つの不対電子(各2p軌道に1つ)をほとんど持っていない。これは、この状態では2価の原子であることを意味します。したがって、結合は2つのみです(-C-)。.
それでは、炭素原子が4つの結合を形成することはどのように可能ですか?これを行うには、2s軌道から2pより高いエネルギーの軌道に電子を促進する必要があります。これが行われると、結果として生じる4つの軌道は次のようになります。 退化する;言い換えれば、それらは同じエネルギーまたは安定性を持っています(それらが整列していることに注意してください).
この過程は混成として知られており、そしてそれのおかげで、今炭素原子は4つの軌道spを持っています3 それぞれ1つの電子と4つのリンクを形成します。これは四価であるというその特性によるものです。.
sp3
炭素原子がsp混成化を有する場合3, その四つの混成軌道を四面体の頂点に向ける。.
だから、あなたはカーボンspを識別することができます3 それは、メタン分子(CH)のように4つの単純な結合しか形成しないからです。4)そしてこの周りに四面体環境を観察することができます.
sp軌道の重なり3 それは非常に効果的で安定しているので、単純なC − C結合は345.6kJ / molのエンタルピーを有する。これが、なぜ無限の炭素質構造と計り知れない数の有機化合物があるのかを説明しています。これに加えて、炭素原子は他の種類の結合を形成することができる。.
sp2 そしてsp
炭素原子はまた、それが二重または三重結合さえも形成することを可能にする他のハイブリダイゼーションを採用することができる。.
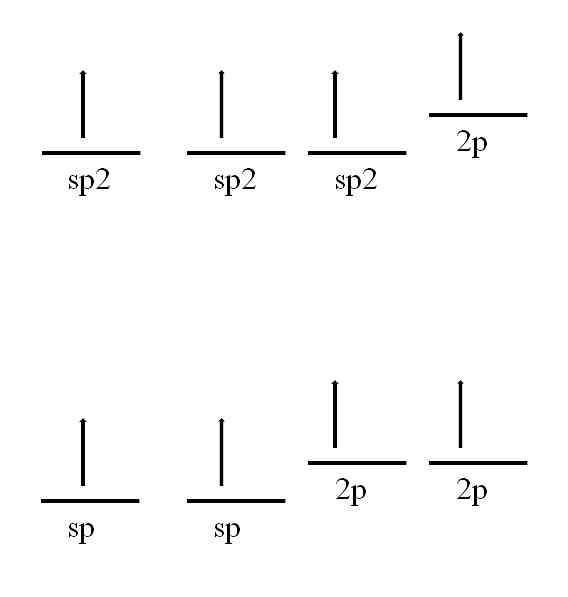
spハイブリダイゼーション2, 画像に見られるように、3つのsp軌道があります2 2p軌道は変質していないか、「純粋」なままです。 3つのsp軌道で2 120º離れたところで、炭素は三角平面の電子幾何学を描くことによって3つの共有結合を形成します。一方、他の3つに垂直な2p軌道で、それは結合πを形成します:-C = C-.
spハイブリダイゼーションの場合、180°離れた2つのsp軌道があるため、それらは線形の電子形状を描きます。今回、それらは互いに垂直な2つの純粋な2p軌道を持ち、炭素が三重結合または2つの二重結合を形成することを可能にします。 ).
常に(通常は)カーボンの周りにリンクを追加すると、その数は4になることがわかります。この情報は、ルイス構造または分子構造を描くときに不可欠です。 5つの結合を形成する炭素原子(= C≡C)は理論的および実験的に許容されない.
分類
炭素原子はどのように分類されますか?内部特性による分類よりも、それは実際には分子環境に依存します。つまり、分子内の炭素原子は次のように分類できます。.
一次
一次炭素は、他の炭素にのみ結合しているものである。例えば、エタンの分子、CH3-CH3 2つの結合した一次炭素からなる。これは炭素鎖の終点または始点を示します.
二次
それは2つの炭素につながっているものです。だから、プロパン分子については、CH3-CH2-CH3, 媒体の炭素原子は二級である(メチレン基、-CH2-).
三次
それらから主鎖の枝が現れるので、三級炭素は他のものとは異なる。例えば、2-メチルブタン(イソペンタンとも呼ばれる)、CH3-CH(CH3)-CH2-CH3 それは太字で強調表示された三級炭素を持っています.
第四紀
そして最後に、その名前が示すように、四級炭素は他の4個の炭素原子に結合しています。ネオペンタンの分子, C(CH3)4 四級炭素原子を有する.
用途
原子質量単位
の平均原子質量 12年Cは、他の元素の質量計算のための標準的な尺度として使われています。したがって、水素はこの炭素同位体の12分の1の重さがあります。 原子質量単位.
このように、他の原子量はのそれと比較することができます 12年Cと 1例えば、マグネシウム(24Mg)は、炭素原子の約2倍、水素原子の24倍の重さがあります。.
炭素循環と寿命
植物はCOを吸収する2 光合成の過程で大気中に酸素を放出し、植物の肺として機能します。彼らが死ぬとき、彼らは炭になります、そしてそれは燃えた後、COを放出します2. 一部は植物に戻りますが、もう一方は海底になり、多くの微生物を養います.
微生物が死んだとき、その生物学的分解物への残りの固体は沈殿し、そして数百万年後に、それは油として知られているものに変換される.
人類が石炭の燃焼に代わるエネルギー源としてこの油を使うとき、それはより多くのCOの放出に貢献します2 (およびその他の望ましくないガス).
一方、生命はその最も深い基盤からの炭素原子を使用しています。これは、DNAと同じくらい重要な高分子を構成する鎖と分子構造を形成することを可能にするその結合の安定性によるものです。.
NMRスペクトロスコピー 13年C
の 13年Cのそれよりもはるかに小さい割合であるにもかかわらず、 12年C、その存在量は、炭素-13核磁気共鳴分光法によって分子構造を解明するのに十分である.
この分析技術のおかげで、どの原子が周囲の原子を取り囲んでいるかを判断できます。 13年Cとそれらがどの官能基に属するか従って、任意の有機化合物の炭素骨格を決定することができる。.
参考文献
- Graham Solomons T.W.、Craig B. Fryhle。有機化学アミン(第10版)ワイリープラス.
- ブレイクD.(2018年5月4日)。炭素の4つの特性取得元:sciencing.com
- 化学の王立協会。 (2018)。カーボン撮影者:rsc.org
- 進化を理解する(S.F.)。炭素原子の旅から取得しました:evolution.berkeley.edu
- ブリタニカ百科事典(2018年3月14日)。カーボン取得元:britannica.com
- Pappas S.(2017年9月29日)炭素についての事実取得元:livescience.com


