胞子染色の基礎、技術および用途
の 胞子染色 不利な状況にあるときにいくつかの細菌属を形成する耐性構造を着色するために使用される方法論である。これらの構造は生き残りの方法に対応します.
胞子を形成する属はたくさんあります。しかし、主なものはバチルスとクロストリジウムです。これらの属は、それらがヒトに対して病原性の種を有するので、より関連性があると考えられる。.
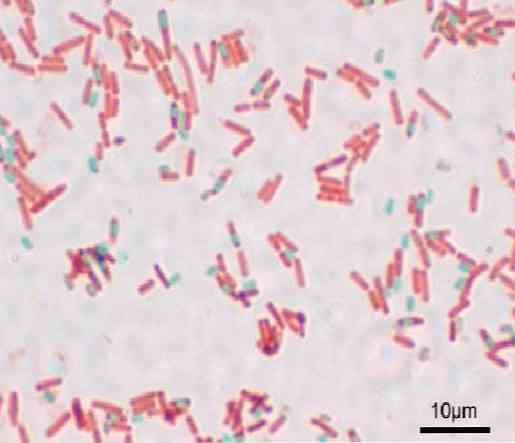
各桿菌は胞子を生じさせることができます。調製物を染色する時点で、芽胞は桿菌の内側(内生胞子)またはその外側(外生胞子)に見出すことができる。グラム染色などの従来の細菌染色法では、胞子は無色のままです。.
現在のところ、胞子の厚い構造を横切ってそれを染色することができるいくつかの着色方法がある。これらの方法論は非常に多様です。これらの中で我々は、Dorner法、Möeller染色法、そしてWirtz-Conklinとしても知られるShaeffer-Fulton法を挙げることができる。.
言及されたすべての技術のうち、Shaeffer-Fulton方法論は日常的な実験室で最もよく使われています。それはその名前を1930年に着色を作った2人の微生物学者:アリシアシェファーとマクドナルドフルトンに因む。しかし、時には1900年代の2人の細菌学者に敬意を表してこの技術がWirtz-Conklinと呼ばれることもあります。.
索引
- 1財団
- 2胞子の着色技術
- 2.1ドーナーのテクニック
- 2.2修正ドーナー法
- 2.3 Shaeffer-FultonまたはWirtz-Conklinのテクニック
- 2.4メラー法
- 2.5熱なしの修正メーラー法
- 3つの用途
- 3.1例
- 4参考文献
財団
胞子は非常に厚い壁を持っているので、従来の着色では染まりません。胞子の複雑な構成はほとんどの染料の侵入を防ぎます.
胞子を外側から内側に向かって調べると、次のような層が観察されます。第一に、糖タンパク質によって形成される最も薄い外層である外膜層。.
それから、高温に対する耐性を提供するクチクラが続き、その後にペプチドグリカンからなる皮質が続く。それからプロトプラストを保護する基盤の壁があります.
胞子は、15%のカルシウムとジピコリン酸を含む脱水構造です。それ故、大部分の胞子着色技術は、染料が厚い構造を浸透することができるように熱を加えることに基づいている。.
胞子が染色されると、それは染料を排除することはできません。 Shaeffer-Fulton法では、マラカイトグリーンが栄養細胞に入り、熱を加えると内生胞子と外生胞子にも浸透します。.
水で洗浄すると、色素は栄養細胞から除去されます。これは、緑色のマラカイト染料がわずかに塩基性で、栄養細胞に弱く結合するために起こります。.
その一方で、それは胞子から出ることができず、最後にサフラニンを含む桿菌は対比されます。この基礎は、似たようなことが起こる残りのテクニックにも有効です。.
胞子着色技術
胞子を染色するためには、調べたい疑わしい系統の純粋な文化が必要です。.
微生物を胞子形成させるように刺激するために、培養物を24時間極端な温度にさらす。このためには、培養液を44℃のオーブンまたは冷蔵庫(8℃)に24時間または48時間置くことができます。.
言及された温度であまりにも多くの時間が残されている場合、全ての内生胞子が桿菌を離れているので外生胞子のみが観察されるであろう。.
時間の終わりに、数滴の滅菌生理的溶液を清潔なスライド上に置くべきである。それから穀物の小さい部分は取られ、良い広がりはなされる.
その後それを乾燥させるために放置し、それを熱に固定しそしてそれを以下に説明するいくつかの技術で染色する。
ドーナーのテクニック
1−試験管中で、蒸留水中の胞子形成微生物の濃縮懸濁液を調製し、そして等容量の濾過されたキンウンフェノールフクシンを添加する。.
2- 5から10分間沸騰水で浴槽にチューブを置きます.
3-清潔なスライド上で、一滴の前の懸濁液を一滴の10%ニグロシン水溶液と混合し、煮沸し、濾過する。.
4-穏やかな熱ですぐに広がりそして乾燥する.
5- 100倍対物レンズで検査(液浸).
胞子は赤く染まり、細菌細胞は濃い灰色の背景に対してほぼ無色に見えます。.
修正ドーナー法
1-胞子形成微生物の懸濁液をスライド上に広げ、熱に固定する。.
2−試料を濾紙のストリップで覆い、そこにフェン酸フクシンを加える。蒸気を放出するまで、ブンゼンバーナーの炎で5〜7分間染料を加熱する。それから紙は取り除かれます.
3-水で製剤を洗い、それから吸収紙で乾かす.
4-ニグロシンまたは針を広げるために2番目のスライドを使用して、10%ニグロシンの薄いフィルムで塗抹標本を覆う.
胞子および細菌による着色は、先行技術に記載されているものと同じである。.
Shaeffer-FultonまたはWirtz-Conklinテクニック
1-スライド上に胞子形成微生物の懸濁液で薄いスプレッドを作り、熱にそれを修正する.
2-スライドを5%マラカイトグリーンの水溶液で覆う(濾紙をシートの上に置くことができる).
3-ブンゼンバーナーの炎を加熱して蒸気を逃がし、炎を取り除きます。 6〜10分間操作を繰り返します。手順の間にマラカイトグリーン溶液があまりにも多く蒸発するならば、もっと加えることができます.
4-(それが置かれている場合)ろ紙を取り外し、水で洗浄する.
5-スライドを0.5%水性サフラニンで30秒間カバーする(技術のいくつかの変形例は0.1%水性サフラニンを使用し、3分間放置する)。.
この技術では胞子は緑色で、桿菌は赤色です。.
それは非常に透明または無色に見えるので、若い文化の内生胞子はうまく染まらないという欠点があります。これを避けるために、48時間のインキュベーションの培養液を使用することをお勧めします。.
メラー法
1-塗抹標本をクロロホルムで2分間覆う.
2-クロロホルムを捨てる.
3- 5%クロム酸で5分間覆う.
4-蒸留水で洗う
5-シートはフクシン - フェノールコイで覆われ、蒸気が出るまでブンゼンバーナーの炎にさらされます。それからそれはしばらくの間炎から取り除かれます。操作が10分になるまで繰り返されます.
6-水で洗う.
7-脱色するために酸性化エタノール(塩酸アルコール)を使用する。 20〜30秒放置.
8-蒸留水で洗う.
9-シートをメチレンブルーで5分間覆う.
10-蒸留水で洗う.
11-乾燥させたままにし、サンプルを顕微鏡で撮影する.
胞子は赤と青の桿菌に見えます。蒸気は有毒であり、長期的には発ガン性がある可能性があるため、蒸気を吸い込まないことが重要です。.
熱を加えない修正メラー法
2007年に葉山と彼の共同研究者たちは、メラーのテクニックを改良しました。彼らは染料の加熱工程を取り除き、それをフクシン - フェノール性カルボン酸溶液10ml毎に2滴のTergitol 7界面活性剤の添加で置き換えた。同じ結果が得られた。.
用途
胞子の着色は、病原体の同定、その形状、桿菌内の位置、および栄養細胞を変形させるかどうかなど、病原体の同定に非常に有益で有用な情報を提供します特定の性別内に関与している.
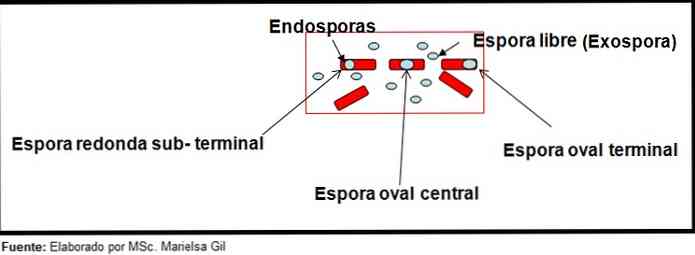
これに関連して、胞子は円形または楕円形であり得、それらは中心または傍中心、副末端または末端位置にも位置し得ることを言及する価値がある。.
例
- クロストリジウムディフィシル 桿菌を変形させる末端位置に楕円形の胞子を形成する.
- の胞子 クロストリジウム 第三 楕円形で、桿菌を変形させず、末端レベルに位置しています.
- の内生胞子 クロストリジウム 破谷 それは末端であり、桿菌を変形させ、ドラムスティックの外観を与える.
- の胞子 ボツリヌス菌, C. ヒストリチカム, C. ノビー そして 敗血症 それらは円形または亜末端楕円形で桿菌を変形させる.
- の内生胞子 クロストリジウム・ソルデリ それはわずかな変形で、中央位置に位置しています.

参考文献
- 葉山M、Oana K、Kozakai T、Umeda S、藤本J、太田H、川上Y。 Eur J Med Res。2007; 16 12(8):356-9.
- ウィキペディアの貢献者。モラー汚れ。ウィキペディア、フリー百科事典。 2018年11月3日、03:28 UTC。 en.wikipedia.orgで入手可能です。
- PérezR、JuárezM、Rodríguez(2011)。微生物学技術マニュアル微生物学基礎科学アカデミー。国立工科大学.
- 「内視鏡」 ウィキペディア、フリー百科事典. 2018年2月25日、10:20 UTC。 10 Jan 2019、02:42:ja.wikipedia.org
- Silva L、Silva C、FernándezN、Bueno C、Torres J、Rico M、MacíasJおよび共同編集者。 (2006)。エストレマドゥーラ自治コミュニティの労働者。具体的な議題集IV。編集MADです。セビリア - スペイン、pp 211-212.
- Silva M、GarcíaM、Corrales J、Ponce E.(2006)。Galician Health Service(SERGAS)の専門検査技師。主題別巻2編集MAD。セビリア - スペイン、pp 79-80.
- Koneman E、Allen S、Janda W、Schreckenberger P、Winn W(2004)。微生物学的診断(第5版)。アルゼンチン、編集Panamericana S.A..
- Forbes B、Sahm D、Weissfeld A.2009。Bailey&Scottの微生物学的診断。 12編アルゼンチンパナメリカーナS.A


