塩化スズ(SnCl 2)の特性、構造、用途およびリスク
の 塩化スズ (II)または塩化第一スズ、化学式SnCl2, は、白色結晶性固体化合物であり、スズと塩酸の濃厚溶液との反応の生成物である:Sn(s)+ 2HCl(濃)=> SnCl2(aq)+ H2(g)その合成(製造)プロセスは、酸と反応するために錫やすり屑の断片を加えることからなる。.
錫片を添加した後、無機塩が得られるまで脱水結晶化を進める。この化合物では、スズがその原子価殻から2つの電子を失い、塩素原子との結合を形成しています.
これはスズ(5s)の原子価配置を考えるともっとよく理解できます。25p×2pそして0pz0)、そのうちの電子対が軌道pを占めている× 陽子Hに与えられる+, 水素の二原子分子を形成するために。つまり、これは酸化還元型の反応です。.
索引
- 1物理的および化学的性質
- 1.1バレンシア設定
- 1.2反応性
- 1.3削減活動
- 2化学構造
- 3つの用途
- 4つのリスク
- 5参考文献
物理的および化学的性質
SnClリンク2 それらはイオン性か共有結合か?塩化スズ(II)の物理的性質は、最初の選択肢を除外する。この化合物の融点と沸点は247℃と623℃で、分子間相互作用が弱いことを示しています。これは共有結合化合物の一般的な事実です。.
その結晶は白色で、可視スペクトルでは吸収がゼロになります。.
バレンシア設定
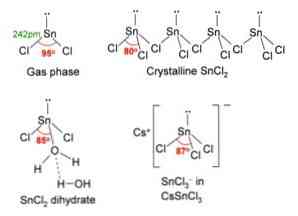
上の画像の左上隅に、孤立したSnCl分子が示されています。2.
中心原子の混成はspであるため、分子形状は平坦であるべきです。2 (3軌道sp2 しかし、自由電子対が体積を占め、塩素原子を押し下げ、分子に角度のある幾何学的形状を与える.
気相では、この化合物は単離されているので、他の分子とは相互作用しません。.
軌道p中の電子対の損失として×, スズはイオンSnに変換されます。2+ その結果の電子構成は5秒です25p×0pそして0pz0, 他の種からのリンクを受け入れるために利用可能なすべてのp軌道を持つ.
Clイオン- Snイオンと配位2+ 塩化スズを生じさせる。この塩の錫の電子配置は5秒です25p×2pそして2pz0, 自由軌道pで他の電子対を受け入れることができるz.
例えば、あなたは別のClイオンを受け入れることができます-, 三方晶平面幾何学(三角底をもつピラミッド)と負に帯電した[SnCl]の複合体を形成する3]-.
反応性
SnCl2 反応性が高く、ルイス酸(電子受容体)のように振る舞い、その原子価オクテットを完成させる傾向があります。.
Clイオンを受け入れるのと同じように-, 同じことが水でも起こり、水分子を直接錫に結合させることによって錫原子を「水和」させ、そして第二の水分子は第一の分子と水素結合相互作用を形成する。.
これの結果はSnClです2 それは純粋ではないが、その二水和塩中の水と配位結合している:SnCl2・2H2○.
SnCl2 極性化合物であるため、水や極性溶媒に非常に溶けやすいです。しかしながら、その質量重量未満の水への溶解度は、加水分解反応(水分子の破裂)を活性化して塩基性および不溶性塩を生成する。
SnCl2(aq)+ H2O(l) <=> Sn(OH)Cl(s)+ HCl(水溶液)
二重矢印は、HCl濃度が増加した場合に平衡が確立され、左側(反応物に向かう方向)に有利であることを示している。このために、SnClソリューションは2 加水分解の不要な塩生成物の沈殿を避けるために、酸性pHを使用します。.
削減活動
空気中の酸素と反応して塩化スズ(IV)または塩化第二スズを生成します。
6 SnCl2(aq)+ O2(g)+ 2H2O(1)=> 2SnCl4(aq)+ 4 Sn(OH)Cl(s)
この反応においてスズは酸化して電気陰性酸素原子との結合を形成し、塩素原子との結合数を増加させる。.
一般に、ハロゲン(F、Cl、BrおよびI)の電気陰性原子はSn(IV)化合物の結合を安定化し、そしてこの事実はなぜSnClが安定であるかを説明する。2 それは還元剤です.
それが酸化してそのすべての価電子を失うとき、Snイオン4+ 5秒構成のままです05p×0pそして0pz0, 軌道5s内の電子対であることが「奪われる」のが最も難しい.
化学構造
SnCl2 のこぎりの歯のような斜方晶系の結晶構造を示し、そこでは歯の先端は塩化物です。.
各列はSnClチェーンです3 他のSn原子とCl架橋を形成する(Cl-Sn(Cl))2-上の画像でわかるように、Cl-···)。 Sn − Cl型の弱い相互作用によって結合された2本の鎖は、配列の1つの層を構成し、それは他の層の上に重なり合っている。.
自由電子対5s2 体積(電子クラウドの体積)を占めるため、構造に歪みが生じます.
Snは9に等しい配位数を有することができ、これは9つの隣人を有するのと同じであり、三角プリズムを幾何学図形の中心に配置し、Clを頂点に配置することに加えてプリズムの正方形の面の.
これは、Sn(濃い灰色の球)が上を向き、それにリンクしている3つのClが三角の床を形成し、3つの上部のClが三角の屋根を形成するチェーンを検討するとより見やすいです。.
用途
有機合成では芳香族ニトロ化合物(Ar-NO)の還元剤として使用されます。2 àAr-NH2)その化学構造は層状であるので、それは触媒担体のための潜在的な候補であることに加えて、有機反応の触媒作用の世界での使用を見出す。.
その還元特性は、金化合物の存在を決定し、銀鏡でガラスをコーティングし、そして酸化防止剤として作用するために使用されます。.
また、その分子構造では三角錐(:SnX 3- M+)(Ptクラスター錯体などの)多数の化合物を合成するためのルイス塩基として使用される。3Sn8Cl20, 無電子対がルイス酸と配位している場合.
リスク
SnCl2 白血球を損傷する可能性があります。それは腐食性、刺激性、発がん性があり、海洋生態系に生息する種に大きな悪影響を及ぼす.
高温で分解し、有害な塩素ガスを放出する可能性があります。高酸化剤と接触すると、爆発的な反応を引き起こす。.
参考文献
- シヴァー&アトキンス。 (2008)。無機化学で グループ14の要素 (第4版、329ページ)。マックグローヒル.
- ケミカルブック. (2017) 2018年3月21日、化学ブックから検索:chemicalbook.com
- PubChem。 (2018)。塩化スズ2018年3月21日にPubChemから取得:pubchem.ncbi.nlm.nih.gov
- ウィキペディア(2017)塩化すず(II) 2018年3月21日、ウィキペディアから取得:en.wikipedia.org
- E. G. Rochow、E. W.(1975). ゲルマニウムの化学:すずと鉛 (初版)。 p − 82.83。ペルガモンプレス.
- F.フーリガー。 (1976)。層状相の構造化学P − 120,121。 D.ライデル出版社.



