硫酸ナトリウムの処方、性質、構造、応用
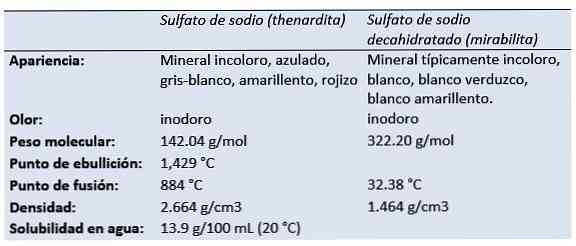
の 硫酸ナトリウム (硫酸二ナトリウム塩、テトラオキシ硫酸硫酸二ナトリウム、ソーダ硫酸塩、グラウバー塩、テナルダイト、ミラビライト)は、式Naの無機化合物である。2そう4 とその関連水和物。すべての形態は水に非常に溶けやすい白い固体です.
市販されている主要な化学製品の1つと考えられています。その世界的な生産量(ほぼ専ら十水和物の形で)は年間約600万トンに達する.

テルダルダイトは、乾燥した蒸発池の中、乾燥した洞窟の中、古くからの採鉱作業で、風解として、そして噴気孔周辺の堆積物として生成される無水硫酸ナトリウム鉱物です。.
それは1825年にSalinas Espartinas(Ciempozuelos、Madrid、Spain)で最初に記述され、フランスの化学者Louis JacquesThénard(1777-1826)を称えてthenarditaと命名された.

1625年、オーストリアの泉の水に硫酸ナトリウム十水和物(後にGlauber塩として知られる)が発見されたオランダ/ドイツの化学者であり、薬剤師のJohann Rudolf Glauber(1604-1670)。彼はその薬効成分のためにそれをミラビリス塩(奇跡的な塩)と呼んだ。.
1650年から1660年の間に、グラウバーは食塩(NaCl)と濃硫酸から硫酸ナトリウムを製造し始めました。このプロセスは化学工業の始まりと見なされます.
その結晶は20世紀まで下剤として使われていました.
18世紀になると、グラウバー塩とカリ(炭酸カリウム)の反応がソーダ灰(炭酸ナトリウム)の工業生産に使われるようになりました。.

それは現在主に洗剤の製造と紙パルプの製造のためのクラフトプロセスで使用されています(紙の製造における主要な方法).
硫酸ナトリウム鉱床は、米国、カナダ、スペイン、イタリア、トルコ、ルーマニア、メキシコ、ボツワナ、中国、エジプト、モンゴル、南アフリカで発見されています。.
主な生産国は中国(江蘇省と四川省)で、スペインがそれに続きます。ここには世界最大のグラウベライト鉱床があります(ブルゴスのCerezo deRíoTirón)。.
天然硫酸ナトリウムの全世界生産量は約800万トンと推定されており、それは2〜4 Mtの他の工業プロセスの副産物として得られています。.
スペインでは、全国硫酸ナトリウム資源目録および他の最新データに掲載されている情報によると、730 Mtのオーダーの硫酸ナトリウム鉱物の在庫が「埋蔵量」としてカタログされ、300 Mtが「その他の資源」としてカタログされた。.
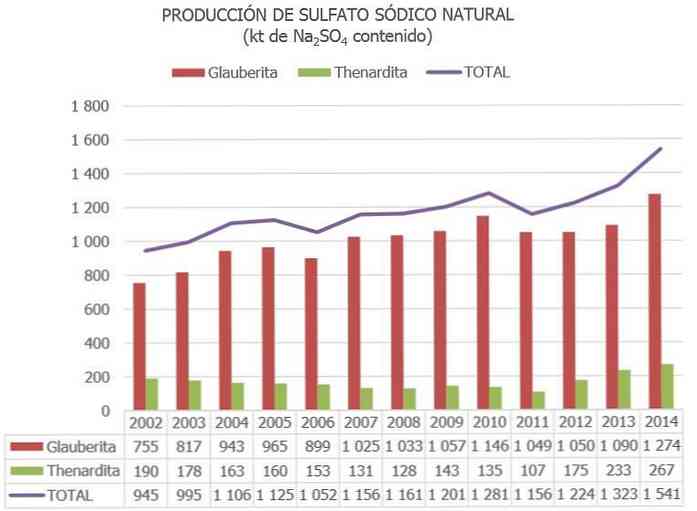
欧州連合では、スペインは現在、硫酸ナトリウムの鉱石(主にテナルディット、グラウベライト、ミラビライト)を含む唯一の国です。.
現在、繊維分野では硫酸ナトリウムの需要が全般的に減少しています.
近年、原料としての低価格のために、洗剤のような他の部門は、特定の地域でいくらかの成長を経験しました.
硫酸ナトリウム洗剤の主な拡大市場は、アジア、中央アメリカ、南アメリカにあります。.
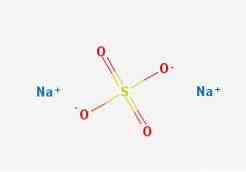
式

二次元構造
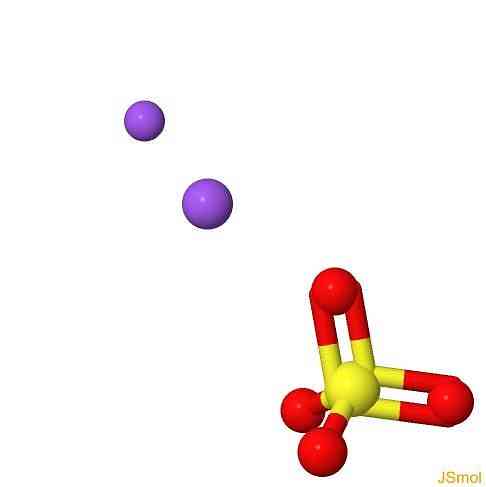
3D構造
特徴
物理的および化学的性質
硫酸ナトリウムはナトリウム化合物の反応性グループに属し、また硫酸塩、硫酸水素塩および二亜硫酸塩のグループに属する.
可燃性
不燃性の物質です。その粉末の爆発の危険性はありません.
反応性
硫酸ナトリウムは水に非常に溶けやすく吸湿性があります。それは非常に安定であり、常温でほとんどの酸化剤または還元剤に対して非反応性である。高温では、炭素熱還元によって硫化ナトリウムに変換することができます。.
化学的に非反応性の物質は、典型的な環境条件下では非反応性と見なされます(ただし、比較的極端な状況や触媒作用で反応する可能性があります)。それらは酸化および還元に対して抵抗力がある(極端な条件を除いて).
危険な化学反応
アルミニウムが硫酸ナトリウムまたは硫酸カリウムと一緒に溶かされるとき、激しい爆発が起こります.
毒性
化学的に非反応性の物質は非毒性と見なされます(ただし、このグループの気体物質は窒息剤として作用する可能性があります)。.
硫酸ナトリウムは一般に無毒性と考えられていますが、注意して取り扱わなければなりません。粉末は喘息または一時的な眼の刺激を引き起こす可能性があります。このリスクは目の保護具と紙マスクを着用することで回避できます。.
用途
その主な用途は以下のものです。
- 洗剤パウダー.
- 紙パルプ.
- 織物.
- ガラス.
- 酵素合成(ワイン作り).
- 人間と動物の食べ物.
- 薬局製品.
- 基礎化学一般.
- 鉄鋼プロセス.
- 洗剤パウダー
硫酸ナトリウムはとても安い材料です。その最大の用途は、家庭用粉末洗剤の増量剤としてであり、約1kgを消費します。世界生産の50%新しいコンパクトまたは液体洗剤は硫酸ナトリウムを含まないので、この使用は減少しています.
硫酸ナトリウムのもう一つの用途は、特に米国で、その重要性が減少しています。そしてカナダは、木材パルプの製造のためのクラフトプロセスにあります。プロセスの熱効率の進歩により、硫酸ナトリウムの必要性が大幅に減少しました.
ガラス産業は硫酸ナトリウムに別の重要な用途を提供しています。それはヨーロッパで二番目に大きいアプリケーションです。硫酸ナトリウムは、溶融ガラスから小さな気泡を除去するのに役立ちます.
日本では、硫酸ナトリウムの最大の用途は織物の製造です。硫酸ナトリウムは、染料が繊維に均一に浸透するのを助け、染色に使用されるステンレス鋼容器を腐食しません(代替方法である塩化ナトリウムとは異なります)。.
硫酸ナトリウムは、32℃で与えられる固体から液体への相変化の間のその高い蓄熱容量のために(加熱用途における後の放出のために)低品質の太陽熱を蓄えるのに特に適している。.
冷却用途では、塩化ナトリウム(NaCl)食塩との混合物は融点を18℃に下げる.
実験室では、有機溶液から微量の水分を除去するために、無水硫酸ナトリウムが不活性乾燥剤として広く使用されています。その作用は硫酸マグネシウムのそれより遅いです、しかしそれは化学的に非常に不活性であるのでそれはさまざまな材料で使用することができます.
硫酸ナトリウム十水和物(グラウバー塩)は下剤として歴史的に使用されていました。それは過剰摂取後の体からアセトアミノフェン(アセトアミノフェン)などの特定の薬の排除に効果的です.
硫酸ナトリウムの他の用途としては、カーペット用芳香剤の製造における添加剤としての、家畜飼料における添加剤としての、およびデンプンの製造におけるその使用が挙げられる。.
臨床効果
その治療用途のために、硫酸ナトリウムは便秘症の治療に使用される生理食塩水および下剤下剤のカテゴリーに属する.
生理食塩水は、吸収されていない塩の浸透作用によって腸内に水分を保持し、間接的に蠕動運動を増加させる塩です。.
生理食塩水は消化管による吸収が不十分であるため、大量の摂取をしない限り全身毒性は起こりそうにありません。しかしながら、長時間の暴露は、化合物の浸透圧効果に続発する脱水と電解質の変化を引き起こす可能性があります。.
慢性的な緩下薬の乱用は、摂食障害、Munchausen症候群、または虚偽の障害のある患者に発生する可能性があります。一般に、患者は腹部のけいれんに関連した悪心、嘔吐および下痢を経験する。重度の影響には、脱水、低血圧、高ナトリウム血症、電解質異常などがあります。.
セキュリティとリスク
化学物質の分類と表示のための世界的に調和したシステム(SGA)の危険ステートメント.
化学物質の分類と表示のための世界的に統一されたシステム(SGA)は、国際的に合意されたシステムです。ユナイテッド、2015).
危険有害性クラス(およびGHSの対応する章)、分類および表示基準、および硫酸ナトリウムに関する推奨事項は次のとおりです(European Chemicals Agency、2017、国連、2015、PubChem、2017)。
GHSの危険クラス
H315:皮膚を刺激する[警告皮膚腐食性/刺激 - カテゴリ2].
H317:アレルギー性皮膚反応を起こす可能性[警告感作、皮膚 - カテゴリー1].
H319:深刻な眼の刺激を引き起こす[警告深刻な眼の損傷/眼の刺激 - カテゴリー2A].
H412:長期にわたり悪影響を及ぼす水生生物に有害[水生環境に有害、長期の危険性 - カテゴリー3].
(PubChem、2017)
健全性審議会のコード
P261、P264、P272、P273、P280、P302 + P352、P305 + P351 + P338、P321、P332 + P313、P333 + P313、P337 + P313、P362、P363、およびP501.
参考文献
- ChemIDplus(2017)7757-82-6 - 無水硫酸ナトリウムの3D構造[画像]取得元:chem.nlm.nih.gov.
- ChemIDplus(2017)7727-73-3 - 硫酸ナトリウムの立体構造[USP] [画像]取得元:chem.nlm.nih.gov.
- Dyet、D.(2007)ネバダ州ソダビルミネラル郡の近くのセルダイト硫酸ナトリウム[画像]投稿者:en.wikipedia.org.
- 欧州化学品庁(ECHA)、(2017)。分類とラベリングの要約調和のとれた分類 - 規則附属書VI(EC)No 1272/2008(CLP規則)。硫酸ナトリウム.
- Grumetisho(2012)Mirabilita [画像]から取得したもの:es.wikipedia.org.
- 有害物質データバンク(HSDB)。 TOXNET (2017)硫酸ナトリウムベセスダ、MD、EU:国立医学図書館。取得元:toxnet.nlm.nih.gov.
- スペインの地質鉱業研究所(IGME)(2016)。 GLAUBERITA-THENARDITA(天然硫酸ナトリウム)2014年。鉱山のパノラマ。以下から取得しました:igme.es.
- 労働安全研究所(INSHT)。 (2010)。国際安全化学記録硫酸ナトリウム雇用安全保障省。マドリッドES取得元:insht.es.
- Langbein Rise(2008)連続クラフトパルプミル[画像]取得元:wikimedia.org.
- 国連(2015)化学製品の分類と表示のための世界的に調和したシステム(SGA)第6改訂版。ニューヨーク、アメリカ合衆国:国連出版物。取得元:unece.org.
- 国立バイオテクノロジー情報センターPubChem化合物データベース(2016)硫酸ナトリウム - PubChem Structure [画像]ベセスダ、メリーランド州、EU:米国国立図書館。取得元:pubchem.ncbi.nlm.nih.gov.
- 国立バイオテクノロジー情報センターPubChem化合物データベース(2016)硫酸ナトリウム - PubChem Structure [画像] Bethesda、MD、EU:国立医学図書館.
- 国立バイオテクノロジー情報センターPubChem化合物データベース。 (2017)硫酸ナトリウム十水和。ベセスダ、MD、EU:国立医学図書館。取得元:pubchem.ncbi.nlm.nih.gov.
- 国立バイオテクノロジー情報センターPubChem化合物データベース。 (2017)硫酸ナトリウムベセスダ、MD、EU:国立医学図書館。取得元:pubchem.ncbi.nlm.nih.gov.
- Walkerma(2005)硫酸ナトリウム[画像]取得元:wikimedia.org.
- ウィキペディア(2017)クラフトプロセス。取得元:wikipedia.org.
- ウィキペディア(2017)ミラビリタ。取得元:wikipedia.org.
- ウィキペディア(2017)ミラビライト。取得元:wikipedia.org.
- ウィキペディア(2017)硫酸ナトリウム。取得元:wikipedia.org.
- ウィキペディア(2017)Solfato di sodium decaidrate。 https://it.wikipedia.orgから取得しました.
- ウィキペディア(2017)硫酸ナトリウム。取得元:wikipedia.org.
- ウィキペディア(2017)Thenardita。取得元:wikipedia.org.
- ウィキペディア(2017)Thenardite。以下から取得しました。.


